Microsoft Word - 00 Zbirka seminarskih zadataka - pismeni ispit
|
|
|
- Izidor Stefanović
- пре 6 година
- Прикази:
Транскрипт
1 Sveučlšte u Zagrebu Fakultet kemjskog nženjerstva tehnologje Zavod za fzkalnu kemju Božena Pntarć, Zvonmr Matusnovć, Marko Rogošć KEMIJSKO-INŽENJERSKA TERMODINAMIKA (zadac za semnare smen st) Zagreb, lanj 03
2
3 PREDGOVOR Ova zbrka sadrž rješene zadatke za numerčke semnare koj se u okvru kolegja Termodnamka realnh sustava (danas od nazvom Kemjsko-nženjerska termodnamka) održavaju još od uvođenja toga kolegja u šk g 978/979 na tadašnj Kemjsko-tehnološk studj Tehnološkoga fakulteta Semnarsk zadac dožvjel su u roteklh vše od 30 godna određene romjene, al su zadržal osnovnu koncecju rema kojoj student rješavaju robleme z odručja kemjsko-nženjerske termodnamke rmjenjujuć djagrame, termodnamčke tablce kalkulatore, uz ogrančenu rmjenu numerčkh metoda Za rmjenu osobnh računala, name, rezervran su termn vježb u računalnoj učonc Zadac su usklađen s nastavnm rogramom Ovo je važno staknut jer se r usoređvanju sa slčnm zbrkama treba vodt računa o tome da se nastava kemjsko-nženjerske termodnamke uvelke razlkuje od učlšta do učlšta Termodnamčk se sadržaj u ravlu rovlače kroz nz kolegja razlčto su organzran u ojednm kurkulumma Sadržaje koj nek čtatelj možda ovdje očekuju, a ne nalaze h, treba stoga otražt u drugm nastavnh tekstovma Fakulteta kemjskog nženjerstva tehnologje l drugdje Osnovn koncet numerčkh semnara osmslla je zadatke odabrala dr sc Božena Pntarć, dugogodšnja asstentca u Zavodu za fzkalnu kemju Fakulteta kemjskog nženjerstva tehnologje Sveučlšta u Zagrebu Do tekstova rremo je njen nasljednk, dr sc Zvonmr Matusnovć Semnarske zadatke je u konačnu formu oblkovao rof dr sc Marko Rogošć Zbrka sadrž 4 rješen rmjer Svak rmjer oraćen je u otrebnoj mjer teorjskm osnovama komentarma, a sadrž detaljno tumačenje načna rješavanja s međurezultatma kako b se studentma olakšala rrema zadataka za smen do sta Svak je zadatak oraćen osebnm lteraturnm navodma, te osnovnm lteraturnm zvorom Marko Rogošć Zagreb, lanj 03
4 v
5 SADRŽAJ Volumen realnog jednokomonentnog fluda Volumen realnog jednokomonentnog fluda 6 3 Volumen realnog jednokomonentnog fluda 4 Tlak realnog jednokomonentnog fluda 30 5 Temeratura realnog jednokomonentnog fluda 35 6 Fugactvnost realnog jednokomonentnog fluda 4 7 Fugactvnost realnog jednokomonentnog fluda 48 8 Fugactvnost realnog jednokomonentnog fluda 55 9 Fugactvnost realnog jednokomonentnog fluda 60 0 Volumen realne lnske smjese 67 Volumen realne lnske smjese 74 Temeratura realne lnske smjese 8 3 Tlak realne lnske smjese 86 4 Fugactvnost realne lnske smjese 89 5 Fugactvnost realne lnske smjese 98 6 Krtčn molarn volumen Veteré 06 7 Koefcjent acentrčnost Edmster; Lee Kesler 08 8 Krtčna svojstva Lydersen 9 Krtčna gustoća Calletet Mathas 4 0 Krtčn tlak Kreglewsk Kay 7 Pseudokrtčn arametr Funkcje odstuanja Lee Kesler 6 3 Parcjaln molarn volumen grafčko dferencranje 34 4 Parcjaln molarn volumen metoda odsječka 38 5 Parcjaln molarn volumen emrjska funkcja 43 6 Parcjalne molarne entalje grafčko dferencranje 47 7 Parcjalne molarne entalje emrjska funkcja 55 8 Parcjalne molarne entalje rvdne molarne velčne 58 9 Test konzstentnost Standardna stanja kod ravnoteže ara kaljevna 7 3 Koefcjent aktvnost emrjska funkcja 79 3 Aktvnost grafčko određvanje; Gbbs Duhem Model koefcjenta aktvnost ASOG 9 34 Model koefcjenta aktvnost UNIFAC Model koefcjenta aktvnost NRTL 36 Standardna stanja kod ravnoteže ara kaljevna 7 37 Standardna stanja kod ravnoteže ara kaljevna 38 Van Laarov model koefcjenta aktvnost 7 39 Van Laarov model koefcjenta aktvnost 3 40 Ravnoteža kaljevna krutna u trokutnom djagramu 36 v
6 Volumen realnog jednokomonentnog fluda Izračunat volumen 00 kg CO r tlaku od 5,0 MPa temeratur od 00 C Pretostavt da se ln r tm uvjetma vlada rema: A) Redlch-Kwongovoj jednadžb stanja; ) volumen računat ostukom zravne teracje, ) volumen računat Newtonovom metodom tangente; B) korgranoj oćoj lnskoj jednadžb stanja r čemu koefcjent komresblnost treba računat kao troarametarsku velčnu (Lee-Keslerov ostuak) Potrebn odac su: T K = 304, K; K = 7,387 MPa; M = 44 g mol - ; = 0,39; a = 0,47480; b = 0, Oća razmatranja o zadatku Molarn volumen lna, v, lako se zračunava z zadane temerature, T, odnosno tlaka,, omoću jednadžbe stanja dealnog lna, oznate još z oće stehometrje: v RT () Prje rješavanja samog zadatka, dobro se rsjett uvjeta u kojma se oća lnska jednadžba može rmjent za računanje svojstava realnh lnova Svojstva realnh lnova rblžavaju se dealnm u slučajevma vsoke temerature nskog tlaka Pojam vsoke temerature, odnosno nskog tlaka ovst će o konkretnom fludu koj se razmatra Sobna temeratura očto je vsoka temeratura rmjerce za ksk (krtčna temeratura kska je T K = 8,6 C), al ne za etanol (krtčna temeratura etanola je T K = 4 C), što se očtuje u razlčtm svojstvma fluda Name, ksk je r sobnoj temeratur atmosferskom tlaku ermanentn ln, a etanol kaljevna Za referentnu točku razmatranja o vsn temerature tlaka uzma se, dakle, krtčna točka fluda Treba dakle razmslt je l zadana temeratura od 00 C vsoka u odnosu na krtčnu od 304, K (nešto vša od sobne), te je l zadan tlak od 5 MPa vsok u odnosu na krtčn koj znos 7,387 MPa za CO Brz odgovor na ovo tanje daje tek skustvo, a rješavanje zadatka može rdonjet stjecanju toga skustva U ovom se slučaju odmah može zaključt da je temeratura CO znad krtčne, te će zračunat molarn volumen CO o fzčkom smslu odgovarat molarnom volumenu lna, odnosno nadkrtčnog fluda, a ne molarnom volumenu kaljevne Redlch-Kwongova jednadžba stanja Godne 949 Redlch Kwong (REDLICH, 949) objavl su rvu modernu jednadžbu stanja trećeg stunja rkladnu za stodobnu rocjenu ravnotežnh molarnh volumena are kaljevne z ogrančenog skua termodnamčkh odataka, name z krtčne temerature tlaka fluda Jednadžba je kasnje nauštena u korst točnjh, al je zadržala edagošku vrjednost Jednadžba ovezuje tlak,, temeraturu, T, molarn volumen, v, zrazom ekslctnm o tlaku: RT a () v b Tv v b
7 Rad se o olnomnoj jednadžb trećega stunja o volumenu: 3 RT RTb a ab v v b v T T 0, (3) odnosno koefcjentu komresblnost z: b b a ab 0 (4) RT RT RT T RT T 3 z z z 3 3 Koefcjent komresblnost je omjer molarnog volumena realnog dealnog lna r stm uvjetma tlaka temerature: v v z d v RT (5) U rethodnm su zrazma a b arametr jednadžbe stanja Izračunavaju se z krtčnh arametara, tlaka, K, odnosno temerature, T K, rema: 5 R T a K a, (6) b K RT b K (7) K Koefcjent a b otječu z numerke Redlch-Kwongova olnoma trećeg stunja znose: a ,47480, (8) b 0, (9) 3 Izraz (4) uobčajlo se sat kraće, rema: 3 z z A B B z AB uz: 0, (0) a a r 5 5 r A, () RT T b b r B, () RT T r gdje su r T r reducran tlak, odnosno temeratura U rmjen Redlch-Kwongove jednadžbe stanja na računanje volumetrjskh svojstava lnova treba vodt računa da se rad o emrjskoj jednadžb Naše l se jednadžba u oblku: a vb RT, (3) Tv v b usored s oćom lnskom jednadžbom, ostaje jasan rblžan fzčk smsao arametara Parametar b odnos se na emrjsku korekcju volumena, odnosno znač nauštanje
8 retostavke o zanemarvm dmenzjama čestca lna, dok arametar a rocjenjuje međudjelovanje čestca, odnosno znač nauštanje retostavke o zanemarvm međudjelovanjma čestca Prema Redlch-Kwongovoj jednadžb stanja, međudjelovanja ovse o temeratur o čemu govor kvadratn korjen temerature u nazvnku na ljevoj stran jednadžbe Iskustva u rmjen Redlch-Kwongove jednadžbe stanja govore da se dobr rezultat mogu očekvat u odručju vsokh (ne revsokh) tlakova, al treba zbjegavat odručje revsokh temeratura Veća se odstuanja od stvarnh vrjednost mogu očekvat kod olarnh fluda njhovh smjesa 3 Metoda drektne teracje Drektna (zravna) teracja je numerčka metoda rješavanja nelnearnh jednadžb Ako se oća jednadžba s jednom neoznancom: gx ( ) 0, (4) može rkazat u oblku: x f x, (5) tada se konstrura teratvn ostuak rješavanja oblka: x f x, (6) koj će u određenm uvjetma konvergrat do željenog rješenja x za odabranu očetnu retostavku rješenja x (0) Postuak je lustrran slkom Slka Grafčka lustracja metode drektne teracje Prkazane su dvje funkcje: y = f(x) te y = x, koje odgovaraju desnoj, odnosno ljevoj stran jednadžbe (5) Funkcje se sjeku u točk x (r), koja je rješenje jednadžbe (4) Počevš od x (0), računa se rvo f(x (0) ) na grafu odgovarajuće funkcje, koj se zatm reflektra reko y = x na ascsu, ostajuć nova retostavka x () Postuak se nastavlja do željene točnost, r čemu se uzastona rješenja ostuno rblžavaju ravom rješenju 3
9 4 Rješenje zadatka metodom drektne teracje Zadano je sljedeće: m CO 00 kg, 6 5,0 MPa 5 0 Pa, T 00 C 373,5 K Izračuna se kolčna CO, rema: m 00 n 7,73 mol 3 M 440 Parametr jednadžbe stanja Redlcha Kwonga računaju se rema zrazma (5) (6): RT a 0, ,34 304, a 6,45, b 5,5 K 6 K 7,3870 RT b 0, ,34304, K 6 K 7,3870,965 0 Rad jednostavnost suštene su jednce! Polnom trećeg stunja o volumenu, jednadžba (3) je funkcja: gv () 0, koju, rema teracjskoj shem treba rkazat u oblku: v f v Prkladan oblk jednadžbe je: RT v b, a Tv v b što daje teracjsk ostuak: v RT a Tv v b b Kao rvu aroksmacju ovdje je uobčajeno uvrstt molarn volumen dealnog lna Iz jednadžbe () sljed: RT 8,34373,5 v 6,050 m mol 50 Nova retostavka volumena dobje se rema: v RT a 0 0 Tv v b b, 5 4
10 odnosno, nakon uvrštavanja: v 8,34373,5, , , 5 6,050 6,050, Rješava l se zadatak ješke, na kalkulatoru, rmjećuje se da se crveno, odnosno lavo označen umnošc ojavljuju u svm teracjama, a h je dobro zračunat zasebno, da se skrat ostuak: v 30, 369, , ,050 6,050, Rješenja rvh deset teracja su: v 5, m mol 4 3 v 5,394 0 m mol v v v v 5, m mol , m mol ,399 0 m mol 5, m mol v v v v 5, m mol , m mol ,396 0 m mol 5, m mol Iteracja je rkazana grafčk, na slc 0,0006 fv ( ) 0,00058 fv ( ) 0,0005 0, ,0004 0, ,0003 0,0005 0,000 0, ,000 v v 0,000 0,0004 0,0006 0,0008 0,000 0, , , , , ,00070 Slka Grafčk rkaz teracje r rješavanju romatranog zadatka Na ljevoj slc (veće odručje, manje mjerlo) vdljve su rve dvje teracje Na desnoj slc (veće mjerlo) vdljve su rve četr teracje Na kraju, zračunava se (ekstenzvn) volumen, zahtjevan zadatkom, rema: V 4 3 nv7, 735,39600,537 m 5
11 5 Newtonova metoda tangente Newtonova metoda tangente također je numerčka metoda rješavanja nelnearnh jednadžb Prema toj metod, oća jednadžba s jednom neoznancom: f( x) 0, (7) rješava se sljedećm teratvnm ostukom: x f x x (8) f x Postuak je lustrran slkom 3 Slka 3 Grafčka lustracja Newtonove metode tangente Prkazana je funkcja y = f(x) koja u točk x (r) sječe ascsu daje rješenje jednadžbe koje je rješenje jednadžbe (6) Počevš od x (0), računa se f(x (0) ) f'(x (0) ), odnosno znos funkcje njene dervacje Buduć da je znos dervacje zaravo tangens kuta nagba tangente, odnosno omjer nasurotne rležeće katete ravokutnog trokuta, z slke se vd da vrjed: f'(x (0) ) = f(x (0) )/(x (0) x () ) Jednostavnm razvjanjem toga zraza dolaz se do (7) gdje je x () nova aroksmacja rješenja Postuak se nastavlja do željene točnost, r čemu se uzastona rješenja ostuno rblžavaju ravom rješenju 6 Rješenje zadatka metodom tangente Zadano je kao ranje: mco 00 kg, 6 5,0 MPa 5 0 Pa, T 00 C 373,5 K Kolčna CO zračuna se rema: 6
12 m 00 n 7,73 mol 3 M 440 Parametr jednadžbe stanja Redlcha Kwonga računaju se rema zrazma (5) (6): RT a 0, ,34 304, a 6,45, b 5,5 K 6 K 7,3870 RT b 0, ,34304,,965 0 K 6 K 7,3870 Ovdje treba računat A, odnosno B, rema (0), odnosno (): 6 a 6, 4550 A 0,735, RT 5,5 8,34 373,5 5 6 b, B 0,0478 RT 8,34373,5 Rad jednostavnost suštene su sve jednce! Sada je zrazom (9) otuno defnran olnom trećeg stunja o koefcjentu komresblnost: 0 3 z z A B B z AB To je funkcja: f( z) 0, koja se metodom tangente rješava rema: z gdje je: f z z, f z 3 f z z z AB B z AB, (9) 3 f z z z AB B (0) Polnom f(z) ma tr realna rješenja sod krtčne temerature, a samo jedno znad nje, što je slučaj u ovomu zadatku Kao očetna retostavka ovdje se odabre dealn ln Koefcjent komresblnost dealnog lna je: 0 v z RT Iznos olnoma f(z) njegove dervacje f'(z) u rvoj teracj su: 0 3 z z 3 0,735 0,0478 0,0 f 0,735 0,0478 0, 0,7350,0478 0,5 f 478,34 5 7
13 I ovdje treba rmjett da se crveno označen broj ne mjenja od teracje do teracje, a ga je rad skraćenja računanja dobro zračunat zasebno Nova retostavka koefcjenta komresblnost je: z 0 0 f z 0,5 z 0, f z,34 Sljed dalje: 3 z 0,34 z f 0,8975 0,8975 0,8975 0,7350,0478 0,0989 f 30,8975 0,8975 0, 34 0,7449 z f z 0, 0989 z 0,8975 0,8708 f z 0, z 0,34 z 4 f 0,8708 0,8708 0,8708 0,7350,0478 0,0090 f 30,8708 0,8708 0, 3 0,6567 z f 3 f z 0, 0090 z 0,8708 0,8690 f z 0, 6567 z 0,34 3 z 30, 0, 0,8690 0,8690 0,8690 0,7350,0478, f , , 6509 z f z 5,5090 z 0,8690 0, f z 0, 6509 Konvergencja je brža nego kod metode drektne teracje Na kraju, korekcja se uzma u obzr r zračunavanju traženog volumena Korgrana oća lnska jednadžba je: v zrt () Nakon uvrštavanja defncje molarnog volumena (v =V/n) dobva se: V znrt, zatm: znrt V, 0,86907,738,34373,5 3 V 6, 5 m, 50 što je rješenje zadatka Na slc 4 rkazana je teracja Newtonovom metodom tangente: 8
14 fz ( ) 0,5 0,0 0,5 0,0 0,05-0,05 0, 0,4 0,6 0,8,0, z Slka 4 Grafčk rkaz teracje Newtonovom metodom tangente r rješavanju romatranog zadatka 7 Načelo termodnamčke slčnost Lee-Keslerov ostuak Načelo termodnamčke slčnost odrazumjeva da će dva fluda r stm uvjetma reducranog tlaka, reducrane temerature te još jednog karakterstčnog arametra ovezanog s oložajem krvulje saravanja mat st znos reducranog molarnog volumena (l koefcjenta komresblnost) Treć arametar može bt krtčn koefcjent komresblnost, z K, l, u ovom slučaju, Ptzerov koefcjent acentrčnost, Ptzer je, name, crtajuć krvulje saravanja realnh fluda u reducranom r -T r -djagramu rmjeto (PITZER, 955) da se krvulje saravanja fluda rblžno sferčnh čestca (lement lnov, metan) raktčk reklaaju, te da ostoj određena ravlnost u odstuanju krvulja ovezana s asmetrjom čestca, slka 5,0 r 0,8 voda n-butanol 0,6 0,4 metan n-butan n-oktan argon krton etanol 0, 0 0,5 0,6 0,7 0,8 0,9,0 T r Slka 5 Krvulje saravanja realnh fluda u reducranom -T-djagramu Krvulje saravanja lementh lnova se reklaaju U nzu ugljkovodka odstuanje od referentne krvulje za lemente lnove to je veće što je molekula zduženja U skun olarnh tvar, osm geometrje čestce važnu ulogu ma olarnost čestce, odnosno asmetrja u rasodjel gustoće naboja elektronskog oblaka Zatm je rovedena transformacja krvulja; u skladu s Clausus-Claeyronovom jednadžbom: LV h dln d R T, () rređen je transformran (log r )-(/T r )-djagramu, slka 6 9
15 log r -0,5,0,,,3,4,5,6,7,8 0 T r =0,7 / Tr -,0 argon krton -,5 -,0 metan n-butan n-oktan -,5 voda n-butanol etanol -3,0 Slka 6 Krvulje saravanja realnh fluda u log r -/T r -djagramu Pr reducranoj temeratur od T r = 0,7, log r znos za lemente lnove Dobven su, očekvano, rblžno ravc koj rolaze kroz krtčnu točku koordnata (,0); njhov nagb može se karakterzrat jednm arametrom Ptzer je rad raktčnost rmjeno znos reducranog ravnotežnog tlaka r reducranoj temeratur od T r = 0,7, te je uz transformacju: r T r log, (3) 0,7 rredo ljestvcu koefcjenata acentrčnost koj znose 0 za lemente lnove U načelu, s orastom asmetrčnost čestca lna raste Načelo termodnamčke slčnost može se sada renterretrat na sljedeć načn: Dva fluda stog će r stm uvjetma reducranog tlaka reducrane temerature mat jednak koefcjent komresblnost Potrebno je, dakle, konstrurat generalnu korelacju ta z = f( r, T r, ) koja se zatm može rmjent za rocjenu molarnh volumena fluda r razlčtm uvjetma tlaka temerature Jednu takvu korelacju šroke rmjene rredl su 975 Lee Kesler (LEE, 975) Korelacja je lustrrana slkom 7 Lee Kesler odabral su dva fluda kao čvrste točke svoje korelacje To su argon kao lement ln sferčnh čestca radajućeg malog koefcjenta acentrčnost ( = 0,00, 0, oznaka 0), te n-oktan kao referentn ln zduljenh čestca odgovarajućeg, znatno većeg koefcjenta acentrčnost ( = 0,399, oznaka R) Nelnearnu ovsnost z = f() aroksmral su ravcem koj rolaz dvjema točkama, ( (0), z (0) ) ( (R), z (R) ) odabranh fluda: (0) (R) (0) zz z z (4) (0) (R) (0) Jednadžbu su reuredl, uz (0) 0 u oblk: 0
16 z z (0) z (R) z (0) (R), (5) odnosno, uz: z () (R) (0) z z, (6) (R) u oblk:,, z z T z T (7) (0) () r r r r z z (R) Lee-Kessler z (0) (0) 0 (R) 0,399 Slka 7 Shematsk rkaz Lee-Keslerove troarametarske korelacje za os koefcjenta komresblnost realnh fluda kao funkcje koefcjenta acentrčnost Punom je lnjom rkazana retostavljena nelnearna ovsnost z( r, T r ) = f(), a srekdanm lnjama lnearna aroksmacja ste ovsnost, koja se s retostavljenom ovsnost odudara u točkama koje odgovaraju argonu, (0), n-oktanu, (R) Za komletranje korelacje Lee Kesler zračunal su z (0) z () kao funkcje reducranog tlaka temerature objavl h kao tablce Izračunavanje je rovedeno na osnov Starlngove modfkacje Benedct-Webb-Rubnove (BWR) jednadžbe stanja (STARLING, 973), na osnov lteraturnh vrjednost arametara za argon n-oktan 8 Rješenje zadatka metodom Lee-Keslera Kao ranje, vrjed: mco 00 kg, 6 5,0 MPa 5 0 Pa, T 00 C 373,5 K Kolčna CO zračuna se rema: m 00 n 7,73 mol 3 M 440 Za očtavanje koefcjenta komresblnost z tablca o Lee-Kesleru treba rvo zračunat reducrane arametre temerature, odnosno tlaka:
17 T 373,5 T,7,,30 r TK 304,, ,80 r 0, ,60 K 7,3870 Naznačen brojev desno od zračunath reducranh arametara okazuju tablčne vrjednost T r, odnosno r Iz Lee-Keslerovh tablca, slka 8, očtavaju se odgovarajuće tablčne vrjednost z (0) z () Slka 8 a) Očtavanje z (0) za redmetne vrjednost r T r z Lee-Keslerovh tablca
18 Slka 8 b) Očtavanje z () za redmetne vrjednost r T r z Lee-Keslerovh tablca z (0) z () za zračunate r, odnosno T r može se rocjent na osnov tablčnh odataka, rmjenom lnearne nterolacje Formula za lnearnu nterolacju zasnva se na jednadžb ravca kroz dvje točke: y y y y xx x x (8) U konkretnom rmjeru, rvo se rovod nterolacja o tlaku za obje reducrane temerature: 0 0,8330 0,8779 z 0,800 0, 600, 00,8779 0, , z, 0 0,8606, 0 0,8764 0,9083 z 0,800 0, 600,300,9083 0, , z,30 0,8960, a zatm o temeratur: 0 0,8960 0,8606 z,30, 0, 70,8606, 7, 0 0 z, 7 0,870,,, 3
19 Slčno se za z () dobje: 0, , 036 z 0,800 0, 600, 00, 036 0, , 600 z, 0 0,039, 0, 06 0, 049 z 0,800 0, 600,300, 049 0, , 600 z,30 0, 0499, 0, , 039 z,30, 0, 70, 039, 7, 0 z, 7 0, 04 Na kraju, koefcjent komresblnost zračunava se rema (7):,, z z (0) T () r r z Tr r 0,870 0,390,04 0,8803 Volumen se dobva z korgrane oće lnske jednadžbe (): v zrt Sljed uvrštavanje defncje molarnog volumena (v =V/n): V znrt, znrt V, konkretnh brojeva 0,88037,738,34373,5 3 V 6,4 m 50 Očekvano, rezultat dobven ovom metodom donekle se razlkuje od rezultata dobvenh rethodnm dvjema metodama,,, 9 Iteracjska formula za Soave-Redlch-Kwongovu jednadžbu Postuak drektne teracje može se rmjent na Soave-Redlch-Kwongovu jednadžbu stanja (SOAVE, 97) Iteracjska formula tada je: v RT a v v b b Značenje ojednh smbola može se ronać u odgovarajućoj lteratur, rmjerce (ROGOŠIĆ, 03) 4
20 0 Lteratura Izvor: Stanley M Walas, Phase Equlbra n Chemcal Engneerng, Butterworth Publshers, Boston, 985 Ivca Štern, Fzkalna kemja, Prmjer z termodnamke, Tehnčka knjga, Zagreb, 968, str 79 Posebna lteratura: (LEE, 975) Byung Ik Lee, Mchael G Kesler, A Generalzed Thermodynamc Correlaton Based on Three- Parameter Corresondng States, Amercan Insttute of Chemcal Engneers Journal (975) (PITZER, 955) Kenneth S Ptzer, Davd Z Lman, R F Curl, Jr, Charles M Huggns, Donald E Petersen, The Volumetrc and Thermodynamc Proertes of Fluds II Comressblty Factor, Vaor Pressure and Entroy of Vaorzaton, Journal of the Amercan Chemcal Socety 77 (955) (REDLICH, 949) Otto Redlch, Joseh NS Kwong, On The Thermodynamcs of Solutons, Chemcal Revews 44 (949) (ROGOŠIĆ, 03) Marko Rogošć, Kemjsko-nženjerska termodnamka (Nastavn tekstov), Fakultet kemjskog nženjerstva tehnologje Sveučlšta u Zagrebu (ntern tekst), Zagreb, 03 (SOAVE, 97) Gorgo Soave, Equlbrum Constants from a Modfed Redlch-Kwong Equaton of State, Chemcal Engneerng Scence 7 (97) (STARLING, 973) Kenneth E Starlng, Flud Thermodynamc Proertes for Lght Petroleum Systems, Gulf Publshng Co, Houston, 973 5
21 Volumen realnog jednokomonentnog fluda Izračunat secfčn molarn volumen roana r temeratur od 33,6 C tlaku od 84 atm, uz retostavku da se roan r tm uvjetma vlada rema korgranoj oćoj lnskoj jednadžb stanja Koefcjent komresblnost računat kao: A) dvoarametarsku velčnu (z--t-djagram); B) troarametarsku velčnu (Lee-Keslerov ostuak) Potrebn odac su: T K = 369,8 K; K = 4,9 atm; M = 44, g mol - ; ω = 0,5 Oća razmatranja o zadatku Molarn volumen lna, v, omjer je volumena lna njegove kolčne Secfčn volumen je, ak, omjer volumena mase lna Jedan se lako zračunava z drugoga oznaje l se molarna masa lna Usoredba zadane temerature, T, krtčne temeratura lna, T K, okazuje da se on nalaz znad krtčne temerature, dakle ne može se ukaljt Dakle, za zadane uvjete tlaka temerature očekuje se samo jedno rješenje za molarn volumen lna, neovsno o korelacj rmjenjenoj za njegovo zračunavanje Korgrana oća lnska jednadžba Oća lnska jednadžba rmjenjva za realne flude r vsokm temeraturama nskm tlakovma Svaka njena korekcja, u načelu, rozvod korgranu oću lnsku jednadžbu Pod ojmom korgrane oće lnske jednadžbe, međutm, ovdje se odrazumjeva samo oblk: v = zrt, () u kojem se koefcjent komresblnost, z, ne zračunava uz omoć analtčke jednadžbe stanja, već se za njegovu rocjenu korste grafčke l tablčne korelacje Koefcjent komresblnost je omjer molarnog volumena realnog dealnog lna: v v z = d v = RT, () služ kao mjera odstuanja volumena od dealnost Grafčke l tablčne korelacje mogu odgovarat načelu koresondentnh stanja, koje se skazuje relacjom: (, ) z = f T (3) r r Dakle, koefcjent komresblnost funkcja je samo reducranog tlaka reducrane temerature Prmjer grafčke korelacje toga ta daje Standng (STANDING, 94), slka 6
22 0, r,0,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 0,0, z,0 0,9 0,8 0,7 0,6 0,5 0,4, ,00-0,00,5,0,0,40,30,00,70,60,50,00,0,0,30,40,60,80,00 3,0,8,6,4,,0 z 0,3 0,,05 T r =,00 3,00 4,00,8,6 0, 0 6,00 8,00 0,0 T r =5,0,4, r,0 Slka Koefcjent komresblnost kao funkcja reducranog tlaka temerature Krvulje konstrurane na osnov osrednjenh eksermentalnh odataka za rrodne lnove s neznatnm udjelom neugljkovodčnh komonent rema (STANDING, 94) Načelo termodnamčke slčnost kaže da koefcjent komresblnost, osm o reducranom tlaku temeratur, ovs još o jednom arametru Ako je to krtčn koefcjent komresblnost, z K : (,, ) z = f T z, (4) r r K onda se najčešće rad o grafčkm korelacjama zbrkama djagrama kako h rezentraju Hougen Watson (HOUGEN, 964), slka,5,4,3, ooćen koefcjent komresblnost z K=0,7 0,50 0,60 0,70 0,80 0,90, 00,00 3, 00 5,00 0,00 5,00 z,,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0, 0, 0,80 zas ć ena ara 0, 75 0,80 0, 85 0, 85 0, 90 0, 95 0, 90 zasćena kaljevna 0, 95 0,50 T r 0,00 5,00 0 0, 0, 0,3 0,4 0, ,00 5, 00, 00,80, 70,60, 50, 40, 35, 30,5,0,5,0,08, 06, 04, 0, 00 Slka Koefcjent komresblnost kao funkcja reducranog tlaka temerature Krvulje konstrurane na osnov osrednjenh eksermentalnh odataka za lnove krtčnog koefcjenta komresblnost z K = 0,7 Prema (HOUGEN, 984) r 7
23 Ako je treć arametar Ptzerov koefcjent acentrčnost, ω, rad se najčešće o tablčnoj korelacj o Lee-Kesleru (LEE, 973): (,, ) z = f T ω, (5) r r Vše o Ptzerovom koefcjentu acentrčnost Lee-Keslerovoj korelacj nasano je u odjeljku 7 3 Rješenje zadatka omoću z--t-djagrama Zadatak defnra tlak temeraturu roana: 6 = 84 atm = 8,53 0 Pa, T = 33,6 C = 406,75 K Koefcjent komresblnost funkcja je reducrane temerature tlaka, z = f( r,t r ) Izračunavaju se reducran arametr: T 406,75 Tr = = =,0999,0, T 369,8 r K 84 = = =,0048,00 4,9 K Na slc 3 rkazan je djagram z kojeg se za zračunate vrjednost r T r očtava koefcjent komresblnost: z 0, 4 Sljed zračunavanje traženog molarnog volumena: v = zrt, zrt v =, 0,4 8,34 406,75 v = = 6, m mol 8,53 0 Secfčn volumen je: v V = zrt, = znrt, zmrt V =, M v v s = V zrt m = M, s ,4 8,34 406,75 = = 3, m kg 8,53 0 0,
24 Slka 3 Koefcjent komresblnost kao funkcja reducranog tlaka temerature Za vrjednost T r =,0 r =,0 očtava se z = 0,4 4 Rješenje zadatka omoću Lee-Keslerovh tablca Zadatak defnra tlak temeraturu roana: 6 = 84 atm = 8,53 0 Pa, T = 33,6 C = 406,75 K Koefcjent komresblnost funkcja je reducrane temerature tlaka, te Ptzerovog koefcjenta acentrčnost, z = f( r,t r,ω) Izračunavaju se reducran arametr: T 406,75 Tr = = =,0999,0, T 369,8 K 84 r = = =,0048,00 4,9 K 9
25 Za zračunate vrjednost reducranh arametara z Lee-Keslerovh tablca zravno se očtavaju vrjednost z (0), odnosno z (), slka 4 U slučaju otrebe, moguće je nterolrat zmeđu tablčnh vrjednost, vd odjeljak 8 Slka 4 Očtavanje z (0) (gore), odnosno z () (dolje), za redmetne vrjednost r T r z Lee-Keslerovh tablca 0
26 Očtane vrjednost su: ( 0) z 0,3953, ( ) z 0, 0698 Koefcjent komresblnost računa se z očtanh vrjednost, uz oznavanje Ptzerovog koefcjenta acentrčnost, ω: (, ) ω (, ) z = z (0) T () r r + z Tr r = = 0, ,5 0,0698 = = 0,4059 Molarn volumen zračunava se kao ranje: v = zrt, zrt v =, 0,4059 8,34 406,75 v = = 6,673 0 m mol 8,53 0 Također secfčn volumen: v V = zrt, = znrt, zmrt V =, M v v s = V zrt m = M, s ,4059 8,34 406,75 = = 3, m kg 8,53 0 0, Lteratura Izvor: Robert C Red, John M Prausntz, Thomas K Sherwood, The Proertes of Gases and Lquds, 3 zd, Mc Graw Hll, New York, 977 str 34 Posebna lteratura: (HOUGEN, 964) Olaf A Hougen, Kenneth MWatson, Roland A Ragatz, Chemcal Process Prncles charts, 3 zd, Wley, New York, 964 (STANDING, 94) Marshall B Standng, Donald L Katz, Densty of Natural Gases, Amercan Insttute of Mnng, Metallurgcal and Petroleum Engneers Transactons, 46 (94) (LEE, 975) Byung Ik Lee, Mchael G Kesler, A Generalzed Thermodynamc Correlaton Based on Three- Parameter Corresondng States, Amercan Insttute of Chemcal Engneers Journal (975) 50 57
27 Equaton Secton 33 Volumen realnog jednokomonentnog fluda Procjent molarn volumen etana u odručju zasćenja r temeratur od 98 K tlaku od 4,3 atm Pretostavt da se ln r tm uvjetma vlada rema Redlch-Kwongovom modelu Redlch-Kwongovu jednadžbu skazat u olnomnom oblku, f(z) = 0, rješavat je Newton- Gossetovm ostukom Potrebn odac su: T K = 305,5 K; K = 48, atm; = 0,098 3 Oća razmatranja o zadatku Zadatkom se traž molarn volumen etana u odručju zasćenja Termn zasćenje uobčajen je u strojarstvu, kod roučavanja tolnskh strojeva Rad se, name, o tome da je zadana temeratura etana sod krtčne, a etan može ostojat kao kaljevna kao ara U kemjskom se nženjerstvu uobčava govort o ravnotežnoj kaljevn, odnosno ravnotežnoj ar, dok se u strojarstvu govor o zasćenoj kaljevn, odnosno zasćenoj ar Dakle, zadatak traž zračunavanje dvaju razlčth molarnh volumena 3 Redlch-Kwongova jednadžba stanja Godne 949 Redlch Kwong (REDLICH, 949) objavl su rvu modernu jednadžbu stanja trećeg stunja Vše o jednadžb treba otražt u odjeljku, l u drugoj dostunoj lteratur, rmjerce (ROGOŠIĆ, 03) Ovdje se rkazuju samo otrebne jednadžbe, bez njhova komentara: 0, 47480, (3) a 0, (3) b 5 R T a K a, (33) b K RT b K (34) K a a r 5 5 r A, (35) RT T b b r B, (36) RT T r 3 z z A B B z AB 0 (37) 33 Gossetov ostuak rješavanja jednadžb stanja trećeg stunja Godne 986 Robert Gosset suradnc (GOSSET, 986) objavl su djelotvoran brz ostuak teratvnog rješavanja jednadžb stanja trećeg stunja u odručju zasćenja, rmjenjv kako za tadašnje ogrančene mogućnost računala, tako za ručne roračune
28 Oćenta jednadžba stanja može se rkazat kao olnom trećeg stunja koj ma tr, matematčk gledano, realna rješenja u odručju zasćenja, odnosno sod krtčne temerature, r dovoljno nskm tlakovma Na rmjeru Redlch-Kwongove jednadžbe stanja taj olnom rkazan je jednadžbom (37) Traže se nul-točke olnoma: f z 0, (38) 3 f( z) z z AB B zab 0 (39) Polnom je shematsk rkazan na slc 3 Slka 3 Ilustracja jednadžbe stanja kao olnoma trećeg stunja o koefcjentu komresblnost r temeraturama sod krtčne dovoljno nskm tlakovma Od tr matematčk realna rješenja olnoma, fzčk smsao, rema slc 3, mogu mat samo vanjska dva, tj ona u kojma je olnom rastuća funkcja, odnosno ma oztvn nagb To znač da je u točk rješenja rva dervacja olnoma o koefcjentu komresblnost, z, oztvna U konkretnom slučaju Redlch-Kwongove jednadžbe stanja, dervacja glas: 3 f z z z AB B (30) Srednje se rješenje (u kojem je dervacja negatvna) rema fzčkoj slc nužno nalaz unutar nestablnog odručja fluda treba ga odbact jer nema fzčk smsao Gosset suradnc razmatral su u rvom redu načn ncjacje teratvnog ostuka rješavanja olnoma Za do roračuna kojm se traž molarn volumen ravnotežne kaljevne redložl su sljedeću ncjacju: (0) z B (3) Name, rema jednadžb (36), B se zračunava kao: b b b B d RT RT v (3) 3
29 S druge strane, fzčka slka arametra b z van der Waalsove jednadžbe stanja kaže da je b rblžan četverostrukom volumenu čestca fluda, označava mnmalan volumen na koj se može stlačt flud r beskonačno vsokom tlaku Realn volumen lna se, rema van der Waalsovoj jednadžb, asmtotsk rblžavaju arametru b kako tlak tež beskonačnost To znač da van der Waalsova funkcja: RT a, (33) v b v ma vertkalnu asmtotu u -v-djagramu realnog lna r v = b, što se vd u nazvnku rvog člana na desnoj stran rethodne jednadžbe Ista je struktura zadržana kod većne ostalh jednadžb stanja trećeg stunja; sta se asmtota nalaz kod Redlch-Kwongove jednadžbe stanja ekslctne o tlaku: RT a v b Tv v b (34) Prema osanoj fzčkoj slc, odnosno jednadžb (3), arametar B može se shvatt kao (četverostruk!) molarn volumen samh čestca lna, reducran (normran) molarnm volumenom dealnog lna r zadanm uvjetma tlaka temerature Realne su kaljevne kondenzran sustav, odnosno sustav gusto akranh čestca, a se molarn volumen kaljevne reducran na st načn: z L L L L v v v (35) d RT RT v ne mogu btno razlkovat od ncjalne vrjednost B Indeks L ovdje označava kaljevnu (engl lqud) Kod ncjacje are Gosset suradnc rmjenl su rješenje koje se nameće samo o seb; rva retostavljena vrjednost z odgovara dealnoj ar: (0) z, a konačno rješenje je koefcjent komresblnost are: V V V V v v v z (36) d RT RT v Još jedan element njhova ostuka je mjenjanje trenutačne vrjednost z r teracj u slučajevma kada zračunata dervacja f'(z) orm nerhvatljvu negatvnu vrjednost Tada, računa l se molarn volumen are, z treba ovećat za određen znos, rmjerce formulom: z z, (37) a računa l se molarn volumen kaljevne, smanjt za određen znos, rmjerce s: z 0,3z (38) Na taj načn teratvn ostuak zračunavanja koefcjenta komresblnost bjež od nerhvatljva srednjeg rješenja olnoma, koje nema fzčk smsao Gosset suradnc komletral su ostuak zborom metode teracje odabral su jednostavnu Newtonovu metodu tangente 4
30 Dakle, njhov se ostuak jednostavno može rkazat trma koracma, ogodnm za rogramranje na računalu l računanje na aru : ncjacja: za kaljevnu: z B za aru: z v/ RT zračunavanje olnoma f(z): f z? ako je f z 0 roračun završava 3 zračunavanje dervacje olnoma f'(z): z? f rmjent Newtonovu formulu: ako je f z 0 z z f z z f vratt se na točku rmjent z z za aru, odnosno z 0,3z za kaljevnu vratt se na točku ako je f z 0 34 Rješenje zadatka Zadan su tlak temeratura: 6 4,3 atm 4,847 0 Pa, T 98 K Izračunavaju se arametr Redlch-Kwongove jednadžbe stanja: 5,5 RT a K 0, ,34 305,5 a 9,870, 48, 035 b K RT b 0, ,34305,5 4,506 0 K K 48, 035 a 9,8704,3 035 A 0,3898, RT 5,5 8, b 4,5060 4,3 035 B 0,076 RT 8,34 98 Rad jednostavnost suštene su jednce Traže se nul-točke olnoma: 3 f( z) z z AB B zab 0 Prva aroksmacja kod računanja koefcjenta komresblnost are je dealn ln: z 0 v RT 5, 5
31 Izračunavaju se vrjednost olnoma, odnosno njegove rve dervacje: 3 3 f z z z AB B zab, f z z z A B B 0 3 z 0,3898 0,076 0,076 0 z 3 0,3898 0,076 0, 7 f 0,38980,076 0,78 f 0 6,3079 Dervacja je oztvna, znač ne treba korgrat z Djelov formule rkazan crvenom, odnosno zelenom bojom ne mjenjaju se, a h je rad ubrzanja ostuka dobro zračunat zasebno uvrštavat u uzastone teracje Štovše, dentčn su za roračun kaljevte faze Sljed Newtonova formula: z 0 0 f z 0, 78 z 0, f z,3079 U drugoj teracj dobva se: z 3 9 z 3 0,7873 0,3079 f 0,7873 0,7873 0,307 0,7873 0, ,0809, f 0,7873 0,598 z f z 0, 0809 z 0, , 6508 f z 0,598 Rezultat ostalh teracja su: 3 z 0,5685, 4 z 0,565, 5 z 0,59, 6 z 0,54 Molarn volumen are je: v z RT 0,548,3498 3,080 m mol 4,3 035 V V 4 3 Prva aroksmacja kod računanja koefcjenta komresblnost kaljevne je reducran volumen čestca, rethodno već zračunat: 0 b b z B 0, 076 v d RT Prva teracja je: 0 3 z 0, f 0,076 0,076 0,0760,0966 0,06, f 30,076 0,076 0,73 z 0,
32 z 0 0 f z 0, 06 z 0, 076 0,43 0 f z,3079 Rezultat ostalh teracja su: z 0, 09, 3 z 0, 0, 4 z 0, 034 Molarn volumen kaljevne je: v z RT 0,0348,3498,04 0 m mol 4,3 035 L L 4 3 Na slc 3 rkazana je teracja do konačnh rezultata kako za kaljevtu, tako za arnu fazu: fz ( ) 0,3 0, 0, - 0, 0, 0,4 0,6 0,8,0-0, z Slka 3 a) Ilustracja teratvnog ostuka rješavanja Redlch-Kwongove jednadžbe stanja u oblku olnoma trećeg stunja, metodom o Gossetu (Newtonova metoda tangente) f( z) 0,0 0,0-0, 0, 0,4 0,6 0,8,0-0,0 z - 0,0 Slka 3 b) Ilustracja teratvnog ostuka rješavanja Redlch-Kwongove jednadžbe stanja u oblku olnoma trećeg stunja, metodom o Gossetu (Newtonova metoda tangente) Rad boljeg rkaza kaljevte faze ovećano je mjerlo na ordnat 7
33 35 Komentar rezultata zbor stablne faze Pojava dvaju razlčth rezultata za ravnotežne molarne volumene are kaljevne još uvjek ne jamč da su obje faze stablne, vd nr (ROGOŠIĆ, 03) Najjednostavnj načn testranja stablnost je roračun koefcjenta fugactvnost Name, stanje stablne termodnamčke ravnoteže r zadanom tlaku temeratur određeno je mnmumom Gbbsove energje sustava Buduć da se fugactvnost ovezuje s Gbbsovom energjom reko: dg RTd ln f, (39) a koefcjent fugactvnost je: f, (30) stanje nže Gbbsove energje ujedno je stanje nže fugactvnost, odnosno manjega koefcjenta fugactvnost: mn g mn f mn (3) Kemjsko-nženjerska termodnamka daje zraz za zračunavanje koefcjenta fugactvnost z oćente jednadžbe stanja: 0 z ln d, (3) gdje je z koefcjent komresblnost, dakle volumetrjsko svojstvo koje se načelno zračunava z jednadžbe stanja Izraz za Redlch-Kwongovu jednadžbu stanja zveden z (369) glas: ln ln v a ln v z ln z, (33) 3 vb brt vb Buduć da su vrjednost z, odnosno v već zračunate za arnu kaljevtu fazu, sljed jednostavno uvrštavanje rezultata Za aru: V V V V V ln ln v a ln v V 3 V z ln z v b brt v b, 4 V 3,080 ln ln 3, , ,870 3, 080 ln 4,5060 8,3498 3, 080 4,5060 0,54 ln 0,54 ln V 0,36736 V 0,6956 Za kaljevnu: ln ln v a ln v ln v b brt v b L L L L L z z L 3 L, 8
34 4 L ln ln, , ln L 0,36333 L, ,870, 040 ln 4,5060 8,3498, 040 4,5060 0,034 ln 0,034 0, Prema rezultatma, stanje nžeg koefcjenta fugactvnost ma ara, dakle ara je u ovom slučaju stablna faza Tek b stanje jednakh koefcjenata fugactvnost are kaljevne odgovaralo ravnotežnom, te se na osnov toga može konstrurat ostuak za zračunavanje ravnotežnog stanja na osnov Redlch-Kwongove ( blo koje druge) jednadžbe stanja trećeg stunja 36 Lteratura Izvor: Jean Vdal, Thermodynamque, Tom I et II, Techn, Pars, 973 str 45 Posebna lteratura: (REDLICH, 949) Otto Redlch, Joseh NS Kwong, On The Thermodynamcs of Solutons, Chemcal Revews 44 (949) (ROGOŠIĆ, 03) Marko Rogošć, Kemjsko-nženjerska termodnamka (Nastavn tekstov), Fakultet kemjskog nženjerstva tehnologje Sveučlšta u Zagrebu (ntern tekst), Zagreb, 03 (GOSSET, 986) Robert Gosset, Georges Heyen, Bors Kaltventzeff, An Effcent Algorthm to Solve Cubc Equatons of State, Flud Phase Equlbra 5 (986)
35 4 Tlak realnog jednokomonentnog fluda Izračunat tlak od kojm se nalaz 000 g vode u sremnku volumena 6 dm 3 r temeratur od 343 C, uz retostavku da se voda r tm uvjetma vlada rema korgranoj oćoj lnskoj jednadžb stanja Koefcjent komresblnost računat kao troarametarsku velčnu rema Lee-Keslerovom ostuku Potrebn odac su: T K = 647 K; K = 8,3 atm; ω = 0,344 4 Oća razmatranja o zadatku Temeratura vode razmjerno je vsoka, al još uvjek sod krtčne, a tlak je vrlo vsok To znač da se ne može a ror odredt u kakvom će se faznom stanju nalazt voda u ovomu sremnku 4 Lee-Keslerova korelacja Tablčnu korelacju šroke rmjene za rocjenu volumetrjskh ostalh termodnamčkh svojstava fluda u oblku z = f( r, T r, ω), koja odgovara načelu termodnamčke slčnost rredl su Lee Kesler (LEE, 975) Vše o korelacj nalaz se u odjeljku 7 Za rješavanje zadatka dovoljno je reć da se rad o dvjema tablcama, z kojh se ščtava z (0) = f( r,t r ) koefcjent komresblnost fluda sferčnh čestca kao funkcja reducranog tlaka temerature, te z () = f( r,t r ) korekcja koefcjenta komresblnost usljed nesferčnost čestca fluda, također kao funkcja reducranog tlaka temerature Koefcjent komresblnost tada se zračunava rema: (, ) ω (, ) z = z T + z T, (4) (0) () r r r r gdje je ω Ptzerov koefcjent acentrčnost 43 Rješenje zadatka Zadatkom su defnran temeratura vode volumen sremnka: T = 343 C = 66,5 K, V =6 dm = 6 0 m Kolčna vode zračunava se z zadane mase: m n = = = 55,556 mol, 3 M 8 0 z čega sljed molarn volumen: v V n , = = =,88 0 m mol Koefcjent komresblnost funkcja je reducranog tlaka, reducrane temerature Ptzerovog koefcjenta acentrčnost: (,, ) z = f T ω r r 30
36 Temeratura je oznata, a reducranu temeraturu nje teško zračunat: T 66,5 T = = = 0,97 r 0,953 0,95 TK 647 Brojev 0,97 0,95 okazuju da se zračunata reducrana temeratura T r = 0,953 nalaz zmeđu tabelranh vrjednost za T r = 0,95, odnosno T r = 0,97 Potrebna je, dakle, (barem) lnearna nterolacja o temeratur rlkom očtavanja dornosa koefcjentu komresblnost z tablca Tlak nje zadan, već se računa Da b se očtal z (0), odnosno z (), otrebno je retostavt tlak u sustavu Dobra očetna retostavka je nr stanje dealnog lna Tlak dealnog lna je: RT 8,34 66,5 = = = ,43 Pa v,88 0 = 75,54 atm Tlak će se u daljnjem ostuku računat teratvno Reducran tlak u rvoj teracj je: 75,54 = = = 0,000 0r 0,804 0,800 K 8,3 Prema rezultatu, otrebna je lnearna nterolacja z (0), odnosno z () očtanh za tablčne vrjednost r = 0,800, odnosno r =,000 Oća formula za lnearnu nterolacju je: y y y = y + x x ( ) x x Interolra se zmeđu očtanh vrjednost z (0), rvo o tlaku: z z z z ( 0 ) ( 0,95) = 0,40 + ( 0,804 0,800) ( 0 ) ( ) 0,95 = 0,46 0,705 0,40,000 0,800 ( 0 ) ( ) = + ( 580) 0,97 0,5580 0,779 0,5 0,005, 0,97 = 0,550 ( 0 ) ( ) a zatm o temeratur: z z ( 0 ) ( 0,953) = 0,46 + ( 0,953 0,95) ( 0 ) ( ) 0,953 = 0,886 0,550 0,46 0,97 0,95 Crvenom su bojom označen brojev koj se u ovoj teracj onavljaju, a h je dobro zračunat zablježt rad manjeg utroška vremena Slčna se nterolacja rovod za vrjednost z () : z z () ( 0,95) = 0, , 005( 0, ,054) () ( ) 0,95 = 0,054,, 3
37 z z z z () ( 0,95) = 0, , 005( 0, ,054) () ( 0,95) = 0,054 () ( 0,953) = 0,054+ ( 0,953 0,95) () ( ) 0,953 = 0,0666 0,66 + 0,054 0,97 0,95 Prva zračunata vrjednost koefcjenta komresblnost je: (, ) ω (, ) ( ) (0) () z = z Tr r + z Tr r = = 0, ,344 0, 0666 = = 0,657 Ova vrjednost služ da b se korgrao retostavljen tlak Iz korgrane oće lnske jednadžbe dobva se nova retostavka tlaka: zrt 0,657 8,34 66,5 = = =,9473 MPa 4 v,88 0 = 9,09 atm Dobvena je vrjednost tlaka vrlo nska u odnosu na očetnu Uzrok tomu je razmjerno mal koefcjent komresblnost z, koj o svojoj vrjednost odgovara kaljevn Dakle, teracja je krenula s arom, a dobvena je kaljevna Proračun će dalje terrat zmeđu are kaljevne, r čemu se može očekvat njegova sora konvergencja Nova vrjednost reducranog tlaka je: 9,09 = = = 0,00 r 0,3347 0,00 K 8,3 Rad kratkoće rkaza reskače se lnearna nterolacja rkazuju se samo konačn rezultat: ( 0 ) ( ) z 0,953 = 0,9463, ( ) ( ) z 0,953 = 0, 067, (, ) ω (, ) ( ) (0) () z = z Tr r + z Tr r = = 0, ,344 0,067 = = 0,9405 Nov tlak je: 4 zrt 0,9405 8,34 66,5 = = = 6,7 MPa v,88 0, = 65, atm 65, = = = 0,800 r 0,7563 0,600 K 8,3 Proračun je onovo u odručju lna! Potunm je roračunom rovedeno osam teracja do konačne konvergencje Rezultat su:, 3
38 z 8 = 0, 7030, zrt 0,7030 8,34 66,5 = = =,46 MPa v,88 0 =,97 atm Rezultat okazuju da će se voda u sremnku nalazt r tlaku od,97 atm Koefcjent komresblnost rtom će bt z = 0,7030, što odgovara (jako nedealnoj) lnskoj faz Očtanja rvh trju teracja rkazana su u odgovarajućm Lee-Keslerovm tablcama na slc 4 Slka 4 a) Očtavanje z (0) za redmetne vrjednost T r varjabln r (rve tr teracje) z Lee-Keslerovh tablca Plavom lnjom označena je rblžna granca are kaljevne Proračun skače z are u kaljevnu od teracje do teracje, a konačn je rezultat jako blzu grančne krvulje 33
39 Slka 4 b) Očtavanje z () za redmetne vrjednost T r varjabln r (rve tr teracje) z Lee-Keslerovh tablca Plavom lnjom označena je rblžna granca are kaljevne Proračun skače z are u kaljevnu od teracje do teracje, a konačn je rezultat jako blzu grančne krvulje 44 Lteratura Izvor: Jean Vdal, Thermodynamque, Tom I et II, Techn, Pars, 973 str 3 Posebna lteratura: (LEE, 975) Byung Ik Lee, Mchael G Kesler, A Generalzed Thermodynamc Correlaton Based on Three- Parameter Corresondng States, Amercan Insttute of Chemcal Engneers Journal (975)
40 Equaton Secton 55 Temeratura realnog jednokomonentnog fluda Izračunat temeraturu r kojoj se nalaz kg kska u sremnku volumena 0,0 m 3, od tlakom od 0,0 MPa Pretostavt da se ksk r tm uvjetma vlada rema: A) korgranoj oćoj lnskoj jednadžb stanja, r čemu koefcjent komresblnost treba računat kao dvoarametarsku velčnu; B) Redlch-Kwongovoj jednadžb stanja (rmjent ostuak drektne teracje) Potrebn odac su: T K = 54,8 K; K = 5,08 MPa 5 Oća razmatranja o zadatku Tlak je razmjerno vsok (00 bar), al odac ne douštaju a ror zaključak o tome hoće l se ksk nalazt u stanju lna l kaljevne To rvenstveno ovs o temeratur, a nju tek treba zračunat 5 Korgrana oća lnska jednadžba, načelo koresondentnh stanja Pod ojmom korgrane oće lnske jednadžbe stanja odrazumjeva se oblk: v zrt, (5) u kojem se koefcjent komresblnost, z, rocjenjuje omoću grafčkh l tablčnh korelacja Ako grafčka l tablčna korelacja odgovaraju načelu koresondentnh stanja, onda se skazuje relacjom: r r z f, T (5) Koefcjent komresblnost funkcja je samo reducranog tlaka reducrane temerature Prmjer grafčke korelacje toga ta daje Standng (STANDING, 94) Vše o korelacjama korgranoj oćoj lnskoj jednadžb stanja ma u odjeljku, l drugdje, nr (ROGOŠIĆ, 0) 53 Rješenje zadatka rema korgranoj oćoj lnskoj jednadžb Zadatkom su defnran volumen sremnka tlak u njemu: 3 V 0,0 m, 7 0,0 MPa 0 Pa Iz zadane mase lako se zračunava kolčna kska: m n 6,5 mol, 3 M 30 z čega sljed molarn volumen: 35
41 V 0,0, m 3 mol - v n 6,5 Koefcjent komresblnost funkcja je reducranog tlaka reducrane temerature: r r z f, T Tlak je oznat, a se lako zračunava reducran tlak: 7 0,9685 r 6 K 5,080 Zadatak će se rješt na osnov z--t-djagrama, to metodom okušaja ogreške Metoda okušaja ogreške služ za rješavanje nelnearnh roblema onda kad se funkcja clja roračuna ne može skazat jednostavnm matematčkm skazma, l se uoće ne može matematčk skazat Dakle, sasvm je uobčajena kod nženjerskh roblema koj uključuju grafčke l tablčne korelacje Metoda, međutm, ne sadrž oćent formalzam svak se roblem rješava na njemu svojstven načn, a otrebno je dobro oznavat fzčku slku roblema Varjabla koju treba zračunat občno se rocjenjuje, a zračunava se oznata varjabla Na temelju odstuanja zračunate stvarne vrjednost oznate varjable određuje se smjer velčna korekcje očetne retostavke neoznate varjable Kao očetne retostavke reducrane temerature odabrat će se vrjednost T r =,4 T r =,5 U korgranu oću lnsku jednadžbu: v zrt, uvrštava se defncja reducrane temerature: T Tr T K Dobje se: v zrtt r K Izraz se koefcjent komresblnost: v z RTT r K Uvrste se oznate vrjednost dobje se koefcjent komresblnost kao funkcja reducrane temerature kao računska korelacja z = f(t r ): 7 4 0,6 0,43 v z RT T 8,3454,8T T K r r r Uvrštavanjem očetnh retostavk T r dobju se dvje računske vrjednost: z(t r =,4) = 0,888, odnosno z(t r =,5) = 0,89 Međutm, z se može odredt z grafčke korelacje z = f( r,t r ), slka 5 Dobvene vrjednost su: z(t r =,4) = 0,805, odnosno z(t r =,5) = 0,860 U točk rješenja moraju se odudarat vrjednost T r određene računsk grafčk Jednostavna skca na slc 5 okazuje kako se određuje smjer otrebne korekcje retostavke T r U rkazanom slučaju, ravc koj rolaze očetnm retostavkama računske grafčke korelacje sjeku se u odručju temeratura zmeđu dvju očetnh retostavk To znač da 36
42 se nova, bolja retostavka temerature mora nalazt zmeđu dvju očetnh Za T r =,45 računska korelacja daje: z(t r =,45) = 0,857, a grafčka: z(t r =,45) = 0,830 Analza na slc 5 sada okazuje da se još bolja retostavka temerature nalaz u ntervalu T r = (,45;,47) Za vrjednost T r =,47 računska grafčka korelacja daju: z(t r =,47) = 0,846 To je, dakle, konačno rješenje za reducranu temeraturu Buduć da je reducrana temeratura znad reducrane krtčne temerature: T r =, rad se o nadkrtčnom fludu, dakle lnu Temeratura se kska tada zračuna rema: T TT r K, 47 54,8 7,56 K Slka 5 Očtavanje z za redmetne vrjednost T r r Boje na djagramu odgovaraju bojama u tekstu 37
43 0,89 0,88 0,87 0,86 z 0,85 0,84 0,83 0,8 0,8 0,80,40,4,44,46,48,50 Slka 5 Ilustracja metode okušaja ogreške za određvanje reducrane temerature na osnov usoredbe računske (una lnja) grafčke (srekdana lnja) korelacje z = f(t r ) za zadan r Boje na djagramu odgovaraju bojama u tekstu T r 54 Redlch-Kwongova jednadžba stanja Vše o Redlch-Kwongovoj jednadžb stanja (REDLICH, 949) nalaz se u odjeljku Ovdje se donose samo otrebne jednadžbe: RT a v b Tv v b K, (53) 5 R T a K a, (54) b RT b K, (55) K 0, 47480, (56) a 0, (57) b 55 Rješenje zadatka metodom drektne teracje Kao u odjeljku 53, zadatkom su defnran volumen sremnka tlak u njemu: 3 V 0,0 m, 7 0, 0 MPa 0 Pa Iz zadane mase zračunava se kolčna kska: m n 6,5 mol, 3 M 30 z čega sljed molarn volumen: 38
44 V 0,0, m 3 mol - v n 6,5 Parametr Redlch-Kwongove jednadžbe su: RT a 0, ,34 54,8 a,734, b 5,5 K 6 K 5,080 RT b 0, ,3454,8 K 6 K 5,080,95 0 Jednce su rad jednostavnost suštene Vše o metod drektne teracje nalaz se u odjeljku 3 Prema toj metod, Redlch- Kwongovu jednadžbu (5) r računanju temerature treba rkazat u oblku: T f T Nakon malo artmetke dolaz se do: v b a T R Tvvb Iteratvn ostuak tada se zasnva na jednadžb: T v b a R T vv b Početna retostavka je temeratura dealnog lna: 7 4 v 0,6 0 T0 9,45 K R 8,34 U rvoj se teracj uvrštava: T,6 0,950,734 8,34 9, 45, 6 0,6 0, Grue brojaka označenh bojama onavljaju se z teracje u teracju, a h je rkladno zasebno zračunat , 78 T, , 45 Rezultat je: T 37,7 K Druga teracja je: T , 78,66 0 0, 37,
45 T 30,9 K Rezultat sljedećh teracja su: T3 3,7 K, T4 3,03 K, T5 3,05 K Posljednja teracja daje rješenje (ovsno o željenoj točnost) 56 Iteracjske formule za Soave-Redlch-Kwongovu, odnosno Peng-Robnsonovu jednadžbu Postuak drektne teracje može se rmjent na Soave-Redlch-Kwongovu jednadžbu stanja (SOAVE, 97) Iteracjska formula tada je: v b a T R vv b Parametar sadrž temeraturu: T T K Parametar funkcja je Ptzerovog koefcjenta acentrčnost: 0, 48508,557 0,563 Formule za Peng-Robnsonovu jednadžbu (PENG, 976) su: T v b a R v bvb, T T K, 0,37464,546 0, 699 Značenje ojednh smbola može se ronać u odgovarajućoj lteratur, rmjerce (ROGOŠIĆ, 03) Sve grue brojeva, odnosno smbola označenh ojednm bojama onavljaju se z teracje u teracju rkladno h je zasebno zračunat 40
46 57 Lteratura Izvor: Ivca Štern, Fzkalna kemja, Prmjer z termodnamke, Tehnčka knjga, Zagreb, 968, str 69 Posebna lteratura: (LEE, 975) Byung Ik Lee, Mchael G Kesler, A Generalzed Thermodynamc Correlaton Based on Three- Parameter Corresondng States, Amercan Insttute of Chemcal Engneers Journal (975) (PENG, 976) Dng-Yu Peng, Donald B Robnson, A New Two-Constant Equaton of State, Industral and Engneerng Chemstry: Fundamentals 5 (976) (REDLICH, 949) Otto Redlch, Joseh NS Kwong, On The Thermodynamcs of Solutons, Chemcal Revews 44 (949) (ROGOŠIĆ, 03) Marko Rogošć, Kemjsko-nženjerska termodnamka (Nastavn tekstov), Fakultet kemjskog nženjerstva tehnologje Sveučlšta u Zagrebu (ntern tekst), Zagreb, 03 (SOAVE, 97) Gorgo Soave, Equlbrum Constants from a Modfed Redlch-Kwong Equaton of State, Chemcal Engneerng Scence 7 (97) (STANDING, 94) Marshall B Standng, Donald L Katz, Densty of Natural Gases, Amercan Insttute of Mnng, Metallurgcal and Petroleum Engneers Transactons, 46 (94)
47 6 Fugactvnost realnog jednokomonentnog fluda Izračunat fugactvnost CO r temeratur od 00 C tlaku od 00 MPa: uz retostavku da se ln r tm uvjetma vlada rema van der Waalsovoj jednadžb stanja Molarn volumen znos v = 5,50-5 m 3 mol - Potrebn odac su: T K = 304, K; K = 73,8 bar 6 Oća razmatranja o zadatku Temeratura CO zadana zadatkom znad je krtčne Dakle, očekuje se jedno rješenje van der Waalsovog olnoma trećeg stunja o volumenu, za zadan tlak temeraturu Ustnu, takvo rješenje ostoj zadano je zadatkom Ovdje, međutm, treba naomenut da volumen nje trebalo zadat jer se u načelu može zračunat z oznatoga tlaka temerature (vd zadatak, nr) Također, treba razumjet da je fugactvnost lna u osnov termodnamčko svojstvo ovezano s jednadžbom stanja da njegovu zračunavanju občno rethod zračunavanje volumena 6 Jednadžba stanja o van der Waalsu Nzozemsk fzčar J D van der Waals je zveo rvu emrjsku jednadžbu stanja koja je bla u mogućnost objasnt ojavu ukaljvanja realnog lna (VAN DER WAALS, 873) Njegova se jednadžba može sat ekslctno o tlaku: RT a, (6) v b v l kao olnom trećeg stunja o volumenu: 3 RT a ab v v b v 0 (6) Oblk olnoma trećeg stunja zadržava se za koefcjent komresblnost z: b a ab 0 (63) 3 3 RT R T R T 3 z z z U rethodnm su zrazma a b arametr jednadžbe stanja Izračunavaju se z krtčnh arametara, tlaka, K, odnosno temerature, T K, rema: 7R TK a, (64) 64 b RT K K (65) 8K Jednadžba stanja o van der Waalsu dala je dobro kvaltatvno tumačenje onašanja vladanja lna u odručju ukaljvanja, al je kasnje u kemjskom nženjerstvu zamjenjena drugm jednadžbama trećeg stunja s boljm kvanttatvnm osom eksermentalnh odataka 4
48 63 Fugactvnost U kemjskom nženjerstvu, sredšnje mjesto u osu faznh ravnoteža ma Gbbsova energja kao mjera odstuanja zatvorenog sustava od ravnotežnog stanja r zadanm ogrančenjma stalnog tlaka stalne temerature,,t = konst Gbbsova energja je zbroj unutrašnje volumne energje lna, umanjen za do neskorstv u retvorb u korstan rad: g u v Ts (66) Buduć da je entalja: hu v, (67) vrjed: g h Ts (68) Ovsnost Gbbsove energje o tlaku temeratur računa se rema: dg vd sdt (69) Pr stalnoj temeratur, ovsnost o tlaku je: dg T vd, (60) gg vd (6) Za dealn ln, buduć da je v = RT/, vrjed sljedeća ovsnost Gbbsove energje o tlaku: RT dg d RTd, (6) T g ln g g RTln (63) Rad se o jednostavnoj logartamskoj ovsnost o varjabl tlaka Za realn ln, Lews (LEWIS, 90) je uveo novu varjablu dmenzjom dentčnu, a svojstvma slčnu tlaku ( korgran tlak ) da b dobo logartamsku ovsnost Gbbsove energje Novu varjablu nazvao je fugactvnost, f Za realn ln vrjed, dakle: ln dg RTd f, (64) T g g RTln f f (65) Defncja fugactvnost uotunjuje se reoznavanjem čnjence da je fugactvnost dealnog lna jednaka njegovu tlaku: f g, (66) te grančnom vrjednošću fugactvnost r nskm tlakovma (gdje se realn ln vlada rblžno dealnom): lm f 0 (67) 43
49 64 Fugactvnost kao korgran tlak volumetrjsko svojstvo Fugactvnost kao korgran tlak osljedca je nedealnost lna računa se z volumetrjskh svojstava Razlka Gbbsove energje realnog dealnog lna zračunava se rema: g ln ln dg dg RTd f RTd, (68) T g g g RT ln RT T f ln (69) Omjer fugactvnost (kao korgranog tlaka ) tlaka,, nazva se koefcjentom fugactvnost Buduć da se u jednadžb (65) fugactvnost ovezuje s Gbbsovom energjom koja nema asolutn znos, nt fugactvnost nema asolutn znos, već se mora odredt u odnosu na neko, dogovorom utvrđeno, standardno stanje Fugactvnost, a kasnje Gbbsova energja, zračunavaju se s obzrom na dogovoreno stanje realnog lna r temeratur sustava tlaku od bar (l atm), kojemu se rdružuje znos fugactvnost od bar ( atm) Na taj načn ostaje moguće zračunat znose asolutne fugactvnost lnova (kasnje kaljevna lnova), a zatm znose razlka Gbbsovh energja sustava u realnom dogovornom, standardnom stanju Iz ovsnost Gbbsove energje o tlaku, odnosno o fugactvnost, r stalnoj temeratur dobva se: vd RTd ln f (60) Djelomčnm ntegrranjem dolaz se do: ln f vd (6) f RT Za dealn ln vrjed slčno: ln RT v d d RT RT (6) Buduć da je dogovorom = f, oduzmanjem rethodnh dvju jednadžb dolaz se do: ln f RT ln v d RT (63) Prkladnm uvrštavanjem jednadžbe stanja v() l u alternatvnm formulacjama (v) može se doć, za blo koju jednadžbu stanja, do zraza za zračunavanje koefcjenta fugactvnost zatm fugactvnost, koj osuju, kako je vdljvo z desne strane jednadžbe (63) odstuanje lna od dealnost, dakle volumetrjska svojstva lna 65 Rješenje zadatka Zadatkom su defnran tlak temeratura CO : 8 00 MPa 0 Pa, 44
50 T =00 C=373,5 K Tlak temeratura u načelu dostaju da se zračuna molarn volumen U načelu, molarn volumen treba rethodno zračunat z ste jednadžbe stanja kao fugactvnost, teratvnm ostucma: v f, T No, buduć da su takv zadac već rkazan (, 3 Zadatak), ovdje se donos samo rješenje: v 5 3 5,5 0 m mol Fugactvnost se rema van der Waalsovoj jednadžb stanja zračunava zrazom: ln f ln RT b a v b v b (64) RTv Prvo treba zračunat arametre a b: 7RT 78,34 304, a 0,3654, ,8 0 b RT K 5 K 8,34304, K 5 8K 873,8 0 4,8 0 5 Sljed uvrštavanje odataka u (64): ln f ln 8,34373, ,80 5 5,5 0 4, ,50 4,80 0,3654 8,34373,55,50 5 Zeleno označen brojev okazuju razlku (v b); razlka je razmjerno mala, molarn volumen lna je mal, a gustoća velka Sljed rezultat: ln f 9,347 3, 487 4, 75, ln f 8,559, f 4,8 MPa Prema rezultatu, fugactvnost je veća od tlaka Pr vsokm tlakovma dobva se oztvno odstuanje lnova od dealnost Trend ovsnost f = f() u otunost sljed trend z = f(), slka 6 Negatvna odstuanja od dealnost r nžm tlakovma rsuju se rvlačnm međudjelovanjma čestca, a oztvna odstuanja r vrlo vsokm tlakovma njhovm odbojnm međudjelovanjma 45
51 z,0 N (0 C) H (0 C) CO (40 C) dealn ln,5,0 0,5 0, / bar Slka 6 Ovsnost koefcjenta komresblnost, z, o tlaku realnog lna, ; eksermentaln odac; rema (BRDIČKA, 969) 66 Druge jednadžbe stanja Na slčan se načn rješavaju zadac s drugm jednadžbama stanja Izraz za koefcjent fugactvnost Redlch-Kwongove jednadžbe jest: ln ln v a ln v 3 zln z, vb brt vb za Soave-Redlch-Kwongovu jednadžbu glas: v a T v ln ln ln zln z, vb brt vb a za Peng-Robnsonovu: v a vb ln ln ln zln z v b brt vb Koefcjent komresblnost je rema defncj: v z, RT a fugactvnost se zračunava rema: f 46
52 67 Lteratura Izvor: Mhal Kh Karaetyants, Chemcal Thermodynamcs, Mr Publshers, Moskva, 978, str 66 Posebna lteratura: (BRDIČKA, 969) Rudolf Brdčka, Osnove fzkalne kemje, Školska Knjga, Zagreb, 969 (LEWIS, 90) Glbert Newton Lews, The Law of Physco-Chemcal Change, Proceedngs of the Amercan Academy of Arts and Scences 37 (90) (VAN DER WAALS, 873) Johannes D van der Waals, Over de Contnutet van den Gas en Vloestoftoestand, Dsertacja, Leden Unversty,
53 Equaton Secton 77 Fugactvnost realnog jednokomonentnog fluda Izračunat koefcjent fugactvnost n-entana r temeratur od 73, K tlaku od atm Pretostavt da se entan r tm uvjetma vlada rema Soave-Redlch-Kwongovom modelu Koefcjent komresblnost zračunat Newton-Gossetovm ostukom, u skladu sa Soave- Redlch-Kwongovom jednadžbom, skazanom u olnomnom oblku, z = f(z) Potrebn odac su: T K = 469,7 K; K = 33,7 bar; = 0,5 7 Oća razmatranja o zadatku Temeratura n-entana zadana zadatkom znatno je sod krtčne U načelu, Soave-Redlch- Kwongov olnom trećeg stunja r takvm uvjetma daje tr matematčk realna rješenja za molarn volumen, odnosno koefcjent komresblnost Srednje rješenje nema fzčkog smsla, a najmanje najveće treba testrat s obzrom na faznu stablnost Za razlku od 6 zadatka, volumen nje zadan već ga treba zračunat r računanju samog koefcjenta fugactvnost 7 Soave-Redlch-Kwongova jednadžba stanja Taljansk termodnamčar Gorgo Soave ublcrao je modfkacju jednadžbe stanja, RK koja je danas oznata kao Soaveova l Soave-Redlch-Kwongova jednadžba (SRK) (SOAVE, 97) Jednadžba je ekslctna o tlaku: RT a (7) vb v vb Rad se o olnomu trećega stunja o volumenu: 3 RT RTb a ab v v b v 0, (7) koefcjentu komresblnost z: b b a ab RT RT RT RT 3 z z z (73) U rethodnm su zrazma a b dva arametra jednadžbe stanja Izračunavaju se z krtčnh (makroskoskh) arametara, tlaka, K, odnosno temerature, T K, rema: R T a K a, (74) b K RT b K (75) K Koefcjent a b st su kao kod Redlch-Kwongova olnoma trećeg stunja: 48
54 a ,47480, (76) b 0, (77) 3 Krać zas jednadžbe (73) je: 3 z z A B B z AB uz: 0, (78) a A RT T a r, (79) r b b r B, (70) RT T r gdje su r T r reducran tlak, odnosno temeratura Jednadžba stanja Soave-Redlch-Kwonga ma tr arametra odgovara načelu termodnamčke slčnost Uz, K T K, treć makroskosk arametar je Ptzerov koefcjent acentrčnost, (vd 7) U jednadžbu stanja ugrađen je reko vrjednost Odgovarajuće jednadžbe su: T r, (7) 0, 48508,557 0,563 (7) Posebno za vodk, Soave je redložo zraz:,0ex 0,3088 T r (73) Jednadžba se šroko rmjenjuje za roračune ravnoteže ara-kaljevna u suvremenom kemjskom nženjerstvu 73 Gossetov ostuak rješavanja jednadžb stanja trećeg stunja Godne 986 Robert Gosset suradnc (GOSSET, 986) objavl su djelotvoran brz ostuak teratvnog rješavanja jednadžb stanja trećeg stunja u odručju zasćenja Postuak je detaljno osan ranje (vd odjeljak 33) Za njegovu rmjenu na Soave-Redlch-Kwongovu jednadžbu stanja otrebno je defnrat olnom trećeg stunja: 3 f( z) z z AB B zab 0, (74) njegovu dervacju o koefcjentu komresblnost: 3 f z z z AB B (75) Proračun traženja nul-točk olnoma f(z) rovod se sljedećm algortmom: 49
55 ncjacja: za kaljevnu: z B za aru: z v/ RT zračunavanje olnoma f(z): f z? ako je f z 0 roračun završava 3 zračunavanje dervacje olnoma f'(z): z? f rmjent Newtonovu formulu: ako je f z 0 z z f z z f vratt se na točku rmjent z z za aru, odnosno z 0,3z za kaljevnu vratt se na točku ako je f z 0 74 Fugactvnost O defncj fugactvnost njenoj vez s volumetrjskm svojstvma jednadžbama stanja vše u odjeljcma Ovdje treba samo naomenut da se fugactvnost može smatrat korgranm tlakom usljed nedealnost lna Fugactvnost se z jednadžb stanja računaju na osnov rethodno zračunath vrjednost molarnh volumena, odnosno koefcjenata komresblnost, a služe za testranje fazne stablnost sustava u konačnc za zračunavanje Gbbsovh energja, odnosno fazne ravnoteže U kemjskom nženjerstvu, sredšnje mjesto u osu faznh ravnoteža ma Gbbsova energja kao mjera odstuanja zatvorenog sustava od ravnotežnog stanja r zadanm ogrančenjma stalnog tlaka stalne temerature,, T = konst Fugactvnost se na osnov Soave-Redlch-Kwongove jednadžbe stanja računa sljedećom jednadžbom: v a T v ln ln ln zln z (76) vb brt vb je koefcjent fugactvnost, omjer fugactvnost f tlaka Stoga je fugactvnost: f (77) 75 Rješenje zadatka Zadatkom su defnran tlak temeratura n-entana: atm 035 Pa, T 73, K Jednadžba stanja trećeg stunja o Soave-Redlch-Kwongu je: 3 z z A B B z AB 0 50
56 Parametr jednadžbe su: RT a K 0, ,34 469, 7 a,9344, 33, b K RT b 0, ,34469,7,004 0 K K 33, Jednce su rad jednostavnost suštene Prje računanja trećeg arametra,, treba zračunat reducranu temeraturu: Tr T TK 73, 469,7 0,5886 Sljed: 0,48508,5570,56 0,48508,5570,50,560,5, 0,8647 T r 0,8647 0,5886r, 456 Zatm se računaju vrjednost A B z skraćenog zasa olnoma trećeg stunja o koefcjentu komresblnost: a,9344, A 0, 055, RT 8,34 73, 4, b B 4,47880 RT 8,34 73, 3 Za roračun arne faze, kao ncjacja Gossetova ostuka (zaravo Newtonove metode tangente) služ koefcjent komresblnost dealnog lna: 0 v z RT Formule otrebne za teracju su: 3 f z z z AB B z AB, 3 f z z z AB B, z f z z f z Nakon uvrštavanja vrjednost dobje se: 4 5
57 f 0 3 z 3 z ,055 4, , ,0554, , f 3 0,055 4, ,47880,0507 z 0 0 f z 0, 0504 z 0,950 0 f z, 0507 Grue brojeva označene crvenom, odnosno zelenom bojom onavljaju se z teracje u teracju Prkladno h je, stoga, zasebno zračunat U sljedećoj teracj dobva se: f z 0,0507 z 30,950 0,0507 0,950 0,950 0,950, 470 4, f 0,950 0,735 z f z 4 4,560 z 0,950 0,954 f z 0, 735 Iteratvn se ostuak rekda nakon ostzanja željene točnost U ovom se zadatku kao rješenje rhvaća eta zračunata vrjednost z: 5 z 0,9467 (Potencjaln) molarn volumen tada je jednostavno, z korgrane oće lnske jednadžbe: V V z RT 0,9467 8,3473, 3 v, 0 m mol, 035 a koefcjent fugactvnost znos: V V V v a T v V V ln ln ln V V z ln z, v b brt v b V,0 ln ln, 0, ,9344, 456,0 ln,0040 8,3473,,0,0040 0,9467 ln 0,9467 V ln 0, ,360, , 0,9467 ln 0,9467 V ln 0,0594, V 0,949386,,, 5
58 Proračun arne faze odvja se na slčan načn, kao ncjacja Gosset-Newtonova ostuka ovdje služ vrjednost arametra B, koja o fzčkom smslu rblžno odgovara reducranom mnmalnom mogućem molarnom volumenu lna (molarnom volumenu maksmalno zbjenh čestca): 0 b b 3 z B 4, v d RT Formule za roračun su: 3 f z z z AB B z AB, 3 f z z z AB B, z f z z f z Prva teracja je: f 3 z 0, z 0,0507 4, , ,47880, , f 34, , ,048 z 0 f z 4,00950 z 4, , f z 0, Nakon ete teracje dolaz se do: z 5, Molarn volumen kaljevne je: L 3 L z RT 5, ,3473,,4 0 4 m 3 mol v 035 Koefcjent fugactvnost je: L L ln L ln v a T ln v L L L L z ln z, v b brt v b 4 L,40 ln ln,4 0 4, ,9344, 456,40 ln,0040 8,3473,,40, , ln 5, L ln, ,36 0, , ln 5, ,, 53
59 L ln,4484, L 0, Komentar rješenja fazna stablnost Prema rasrav z odjeljka 35, stablna faza bt će ona nže fugactvnost, odnosno nžeg koefcjenta fugactvnost, jer to odgovara nžoj vrjednost Gbbsove energje: mn g mn f mn Na osnov dobvenh rezultata, okazuje se da je: V L Stablna faza je kaljevna! Ustnu, koefcjent fugactvnost roračunat je r atmosferskom tlaku Vrelšte n-entana r atmosferskom tlaku znos 36, C (POLING, 000) Buduć da je roračun roveden r rblžno 0 C, n-entan je r tm uvjetma kaljevna 77 Lteratura Izvor: Stanley M Walas, Phase Equlbra n Chemcal Engneerng, Butterworth Publshers, Boston, 985 Posebna lteratura: (GOSSET, 986) Robert Gosset, Georges Heyen, Bors Kaltventzeff, An Effcent Algorthm to Solve Cubc Equatons of State, Flud Phase Equlbra 5 (986) 5 64 (POLING, 000) Bruce E Polng, John M Prausntz, John P O'Connell, The Proertes of Gases and Lquds, McGraw-Hll, New York, 000 (SOAVE, 97) Gorgo Soave, Equlbrum Constants from a Modfed Redlch-Kwong Equaton of State, Chemcal Engneerng Scence 7 (97)
60 Equaton Secton 88 Fugactvnost realnog jednokomonentnog fluda Izračunat koefcjent fugactvnost n-entana r temeratur od 73, K tlaku od atm Pretostavt da se entan r tm uvjetma vlada rema Redlch-Kwongovom modelu Koefcjent komresblnost zračunat Newton-Gossetovm ostukom, u skladu s Redlch- Kwongovom jednadžbom, skazanom u olnomnom oblku, z = f(z) Potrebn odac su: T K = 469,7 K; K = 33,7 bar 8 Oća razmatranja o zadatku Zadatak je dentčan rethodnomu, jedno što je romjenjena jednadžba stanja Temeratura n-entana znatno je sod krtčne Stoga Redlch-Kwongov olnom trećeg stunja r takvm uvjetma daje tr matematčk realna rješenja za molarn volumen, odnosno koefcjent komresblnost Srednje rješenje nema fzčkog smsla, a najmanje najveće se testra s obzrom na faznu stablnost 8 Redlch-Kwongova jednadžba stanja Prkazat će se osnovn zraz Redlch-Kwongove (RK) jednadžbe stanja (REDLICH, 949) otrebn za rješavanje zadatka Jednadžba je trećeg stunja o koefcjentu komresblnost: 3 z z A B B z AB 0 (8) Kod računanja vrjednost A B z skraćenog zasa olnoma trećeg stunja o koefcjentu komresblnost rmjenjuju se zraz: a A,,5 R T b B RT Crvenom bojom označene su razlke u odnosu na jednadžbu SRK Dakle, u brojnku zraza za A nema arametra, a u nazvnku se na temeratur ojavljuje eksonent,5 umjesto kod SRK Mkroskosk arametr jednadžbe stanja su:,5 R T a K a, b K RT b K K Razlka u odnosu na SRK je u eksonentu na krtčnoj temeratur Kod RK on znos,5 u odnosu na kod SRK Jednadžba RK ne ovs o Ptzerovom koefcjentu acentrčnost 55
61 83 Gossetov ostuak rješavanja jednadžb stanja trećeg stunja Postuak Gosseta suradnka (GOSSET, 986) za djelotvorno teratvno rješavanje olnoma trećeg stunja jednadžbe stanja realnog lna detaljno je osan u odjeljku 33 Polnom trećeg stunja Redlch-Kwongove jednadžbe stanja glas: 3 f( z) z z AB B zab 0 (8) Njegova dervacja o koefcjentu komresblnost jest: 3 f z z z AB B (83) Proračun traženja nul-točk olnoma f(z) rovod se sljedećm algortmom: ncjacja: za kaljevnu: z B za aru: z v/ RT zračunavanje olnoma f(z): f z? ako je f z 0 roračun završava 3 zračunavanje dervacje olnoma f'(z): z? f rmjent Newtonovu formulu: ako je f z 0 z z f z z f vratt se na točku rmjent z z za aru, odnosno z 0,3z za kaljevnu vratt se na točku ako je f z 0 84 Fugactvnost U odjeljcma vše je rečeno o defncj fugactvnost njenoj vez s volumetrjskm svojstvma jednadžbama stanja Fugactvnost se z jednadžb stanja računaju na osnov rethodno zračunath vrjednost molarnh volumena, odnosno koefcjenata komresblnost, a služe, zmeđu ostalog, za testranje fazne stablnost sustava Fugactvnost se na osnov Redlch-Kwongove jednadžbe stanja računa sljedećom jednadžbom: A B ln zln zb ln B z (84) je koefcjent fugactvnost, omjer fugactvnost f tlaka Stoga je fugactvnost: f (85) 85 Rješenje zadatka Zadatkom su defnran tlak temeratura n-entana: 56
62 atm 035 Pa, T 73, K Jednadžba stanja trećeg stunja o Redlch-Kwongu je: 3 z z A B B z AB 0 K Parametr jednadžbe su:,5,5 RT a K 0, ,34 469, 7 a 4,935, 33, b RT b 0, ,34469,7,004 0 K K 33, Jednce su rad jednostavnost suštene Vrjednost A B z skraćenog zasa olnoma trećeg stunja o koefcjentu komresblnost su: a 4, A 0, 04984, RT,5,5 8,34 73, 4 b, B 4, RT 8,34 73, 3 Za roračun arne faze, kao ncjacja Gossetova ostuka (zaravo Newtonove metode tangente) služ koefcjent komresblnost dealnog lna: 0 v z RT Formule otrebne za teracju su: 3 f z z z AB B z AB, 3 f z z z AB B, z f z z f z Nakon uvrštavanja vrjednost dobje se: f f 0 3 z 3 z 3 0, , , , , , 47880, , Grue brojeva označene crvenom, odnosno zelenom bojom onavljaju se z teracje u teracju Prkladno h je, stoga, zasebno zračunat: f f 0 3 z z 3 0, ,045,
63 Rezultat rvh nekolko teracja za arnu fazu su: z 0,95686, z 0,9577, 3 z 0,95680 (Potencjaln) molarn volumen tada je z korgrane oće lnske jednadžbe: V V z RT 0,956808,3473, 3 v, m mol, 035 a koefcjent fugactvnost znos: V V V ln z ln z B ln V B z, A V 3 ln 0,95680 ln 0, , ln 3 B 3 0, ,478630, 4, ,95680 V ln 0, , V 0, Kao ncjacja Gosset-Newtonova ostuka za roračun kaljevte faze služ vrjednost arametra B, koja o fzčkom smslu rblžno odgovara reducranom mnmalnom mogućem molarnom volumenu lna (molarnom volumenu maksmalno zbjenh čestca): 0 b b 3 z B 4, v d RT Formule za roračun su: 3 f z z z AB B z AB, 3 f z z z AB B, z f z z f z Međurezultat su: z 0, , z 0, , 3 z 0, , 4 z 0, Nakon četvrte teracje šesta se značajna znamenka vše ne mjenja Molarn volumen kaljevne je: 58
64 L 3 L z RT 5,650 8,3473, 4 3 v, m mol 035 Koefcjent fugactvnost je: L L L ln z ln z B ln L B z, A B 3 L ln 5,650 ln 5,650 4, ln 3 3 L ln 0,737474, L 0, , , , ,650, 86 Komentar rješenja fazna stablnost Prema rasrav z odjeljka 35, stablna faza bt će nžeg koefcjenta fugactvnost koj odgovara nžoj vrjednost Gbbsove energje Na osnov dobvenh rezultata, okazuje se da je: V L, a je stablna kaljevta faza! 87 Lteratura Izvor: Stanley M Walas, Phase Equlbra n Chemcal Engneerng, Butterworth Publshers, Boston, 985 (GOSSET, 986) Robert Gosset, Georges Heyen, Bors Kaltventzeff, An Effcent Algorthm to Solve Cubc Equatons of State, Flud Phase Equlbra 5 (986) 5 64 (REDLICH, 949) Otto Redlch, Joseh NS Kwong, On The Thermodynamcs of Solutons, Chemcal Revews 44 (949)
65 Equaton Secton 99 Fugactvnost realnog jednokomonentnog fluda Izračunat fugactvnost amonjaka r temeratur od 00 C tlakovma od a) 00 atm; b) 400 atm, na temelju zraza: ln f ln d RT 0 Integral rješt grafčk na temelju mjernh odataka navedenh u tablc Površnu odredt rmjenom traezne jednadžbe Ordnatu 0 odredt lnearnom ekstraolacjom Tablčn odac su: /atm v/(cm 3 mol - ) ,8 30,9 76,7 07,4 74, 59,6 47,7 9 Oća razmatranja o zadatku Termodnamka je u rvom redu eksermentalna znanost oblkovana ncjalno tjekom 9 stoljeća Osnovn zakon termodnamke usjel su sstematzrat rezultate brojnh mjerenja u rvom redu volumetrjskh kalormetrjskh odataka za razlčte flude Ovaj zadatak rkazuje jedan sku volumetrjskh odataka načn kako se z tablčnh odataka za jedna svojstva mogu računat, utem termodnamčkh jednadžb, neka druga, manje l vše udaljena svojstva fluda O samom fludu amonjaku ovdje je dovoljno reć da se nalaz znad svoje krtčne temerature od 405,40 K (POLING, 000) 9 Fugactvnost kao volumetrjsko svojstvo Dferencjal Gbbsove energje dg r stalnoj temeratur može se ovezat s romjenom tlaka sustava: dg vd, (9) T odnosno s romjenom fugactvnost, reko osnovne defncjske jednadžbe: ln dg RTd f (9) T Vrjed dakle veza tlaka fugactvnost: vd RTd ln f (93) Djelomčnm ntegrranjem rethodne jednadžbe dobje se: ln f vd (94) f RT Slčan se zraz može zvest za dealn ln: 60
66 ln RT v d d RT RT (95) Izračunavanje asolutnh vrjednost fugactvnost ostaje moguće na osnov konvencje o standardnom znosu fugactvnost fugactvnost realnog lna r nekoj temeratur standardnom tlaku ( bar l, ranje, atm) znos bar l atm Dakle, vrjed: f (96) Na osnov toga, oduzmanjem jednadžb (94) (95) dolaz se do zraza koj koefcjent fugactvnost,, ovezuje s odstuanjem volumetrjskh svojstava realnog lna od dealnost: f RT ln ln v d RT (97) Koefcjent defnra se kao odstuanje molarnog volumena dealnog realnog lna: RT RT Iz rethodnh dvju jednadžb sljed dakle: d v v v z (98) ln RT d, (99) ln f ln d RT, (90) odnosno formula z zadatka: ln f ln d RT (9) 0 Na slc 9 shematsk je rkazano odstuanje molarnog volumena dealnog realnog lna Slka 9 Na ljevoj slc shematsk je rkazano odstuanje molarnog volumena realnog dealnog lna, velčna, a na desnoj je shematsk rkazan kao funkcja tlaka Koefcjent fugactvnost se zračunava z rkazane osjenjene ovršne 6
67 93 Traezna formula Traezna je formula jedna od rasoložvh formula za numerčko ntegrranje funkcja Prkladna je za rmjenu kod tablčnh odataka Ako je zadana funkcja: y f x, (9) Tada se određen ntegral funkcje (ovršna sod krvulje): b a A f x dx, (93) može aroksmrat ovršnom traeza: f a f b Ab a (94) Ukolko su oznate vrjednost funkcje u n ekvdstantnh točaka uzduž ascse, tada se formula za rblžno ntegrranje može sat kao: b h A f xdx f x f x, (95) a n gdje je h udaljenost susjednh točaka uzduž ascse Kada točke u kojma je oznata vrjednost funkcje nsu ekvdstantne, rmjenjuje se sljedeća formula: b n (96) a A f x dx x x f x f x Dakle, u oba slučaja ntegral se aroksmra zbrojem ojednačnh traeza Metoda je lustrrana slkom 9 y=f( x) x 0 x x x 3 x 4 x 5 x 6 x Slka 9 Ilustracja rmjene traezne formule za rblžnu ntegracju Ukuna ovršna sod krvulje aroksmra se zbrojem ovršna traeza Vdljv su zvor mogućh ogrešaka 6
68 94 Rješenje zadatka Zadana je temeratura: T 00 C, odnosno tlakov sustava: 00 atm 400 atm Zadatkom je zadana tablčna ovsnost tlaka o volumenu za zotermu od 00 C: /atm v/cm 3 mol ,8 30,9 76,7 07,4 74, 59,6 47,7 Molarn volumen dealnog lna funkcja je tlaka za zadanu temeraturu Daje se rmjer zračunavanja za rv tabelran tlak: v RT 8, ,5,9460 m mol 0035 d Velčna razlka je molarnog volumena dealnog lna eksermentalnog odatka o molarnom volumenu realnog lna Za rvu točku: d v v,9460,8660 7,564 0 m mol Rezultat za sve eksermentalne točke redom su: v d /cm 3 mol - 94,6 647, ,33 58,8 94,6 55,93 9,4 97,058 /cm 3 mol - 75,64 76,547 77,338 8,9 86,764 8,093 69,809 49,358 Na slc 93 rkazane su zračunate točke ovsnost o tlaku Prema jednadžb 9, donja granca ntegracje je 0 Buduć da za nult tlak ne ostoj eksermentaln odatak, rovod se lnearna ekstraolacja odataka za dvje susjedne točke r najnžm tlakovma ,547 75, , , , m mol Taj se odatak također uključuje u numerčku ntegracju Traezna formula u ovom slučaju glas: A Za rvu ovršnu traeza dobva se: 5 6 7, ,640 A Rad jednostavnost suštaju se dmenzje (Dmenzje su rodukt dmenzja tlaka molarnog volumena) 63
69 3 - / m mol / Pa Slka 93 Prmjena traezne formule za rblžnu ntegracju u redmetnom zadatku Plav smbol su reračunat tabelran odac Crven smbol dobven je lnearnom ekstraolacjom na nult tlak Narančasta ovršna odnos se na tlak od 00 atm, a ukuna ovršna (narančasta žuta) na tlak od 400 atm Dobvene ovršne traeza redom su: A 5,768 A 306,85 A3 3, 45 A4 403,99 A5 47, 689 A6 45,083 A7 38, 59 A 603,74 8 Kod zadatka a) redmetn tlak je 00 atm Rad se, dakle, o zbrajanju rvh trju ovršna traeza: 00 atm, 00 atm d 5, ,85 3, ,863 0 Logartam fugactvnost tada je: ln f ln d RT Fugactvnost je: 0 64
70 f ex ln d RT 0 769,863 ex ln , ,5 f 8,3349 MPa Koefcjent fugactvnost je: f 0,854 Rezultat za zadatak b) su: 400 atm, 400 atm d 30,55 0 (Zbraja se ovršna svh osam traeza) Iz: ln f ln d RT, Sljed: 0 f ex ln d RT 0 30,55 ex ln , ,5 f 8,8446 MPa, te koefcjent fugactvnost: f 0,464953,, 95 Lteratura Izvor: Mhal Kh Karaetyants, Chemcal Thermodynamcs, Mr Publshers, Moskva, 978, str 94 Posebna lteratura: (POLING, 000) Bruce E Polng, John M Prausntz, John P O'Connell, The Proertes of Gases and Lquds, McGraw-Hll, New York,
71 Equaton Secton 00 Volumen realne lnske smjese Izračunat gustoću smjese etena() kska() sastava y = 0,54 r temeratur od 5 C tlaku od 00 atm, uz retostavku da se lnska smjesa r tm uvjetma vlada rema korgranoj oćoj lnskoj jednadžb stanja Koefcjent komresblnost romatrat kao dvoarametarsku velčnu, z M = f( rm, T rm ): A) koefcjent komresblnost računat kao adtvno svojstvo s obzrom na sastav lnske smjese, B) koefcjent komresblnost računat na temelju rethodno zračunath seudokrtčnh arametara u skladu s Kayevm Prausntz-Gunnovm ravlom Potrebn odac su: T K /K K /atm v K /(cm 3 mol - ) z K M/(g mol - ) eten() 8,4 50,8 30,4 0,80 8,054 ksk() 54,8 49,7 73,4 0,88 3,999 0 Oća razmatranja o zadatku Posebna rednost metoda kemjsko-nženjerske termodnamke je u tome što omogućuju rocjenu l redvđanje svojstava smjesa, odnosno všekomonentnh sustava Broj mogućh smjesa raktčk je neogrančen Eksermentalno određvanje željenh svojstava neraktčno je skuo; metode daju brzo manje l vše ouzdano rješenje O smjes fluda z zadatka može se reć sljedeće Obje se komonente nalaze znad svoje krtčne temerature može se retostavt da su njhove smjese također znad krtčne temerature smjese Dakle, smjesa se ne da ukaljt zračunat/rocjenjen molarn volumen, odnosno gustoća, odgovarat će stanju nadkrtčnog fluda 0 Kayeva Prausntz-Gunnova ravla Na osnov razmatranja W B Kaya (KAY, 936) formulrana su tzv Kayeva ravla za zračunavanje seudokrtčnog tlaka, KM, odnosno temerature, T KM, na osnov svojstava krtčnog tlaka, K, temerature, T K, za komonente lnskh smjesa Prema tm ravlma, vrjed: T KM KM yt, (0) K y (0) K Ovdje treba naomenut, da Kayeva ravla ne rocjenjuju stvarnu krtčnu temeraturu, odnosno tlak smjese, već seudokrtčna svojstva za reducranje temerature l tlaka kod lnskh smjesa, s cljem rmjene razlčth korelacja za rocjenu volumetrjskh svojstava, osebce u nadkrtčnom odručju Sam Kay je naglaso da će seudokrtčno svojstvo bt blsko stvarnom krtčnom svojstvu samo za smjese blskh vrelšta Rezultat dobven rmjenom Kayevh ravla okazuju da se mogu očekvat do 0 %-tna odstuanja rocjenjenh stvarnh volumetrjskh svojstava neolarnh lnskh smjesa 67
72 Nešto točnj sku ravla za zračunavanje seudokrtčnog tlaka temerature, s odstuanjma za neolarne smjese do 5 %, dal su Prausntz Gunn (PRAUSNITZ, 958) Jednostavnja, manje točna varjanta th ravla korst sljedeće jednadžbe: T KM KM yt, (03) K yzk yv M RT K KM (04) y (05) M ovdje označavaju Ptzerov koefcjent acentrčnost za smjesu, odnosno komonentu 03 Rješenje zadatka A) Zadana je smjesa: eten() ksk() Temeratura tlak sustava su: T 5 C 98,5 K, 00 atm Molarn udo etena je: y 0, 54 Zadatak će se rješt na osnov retostavke o adtvnom koefcjentu komresblnost (koja nje eksermentalno otvrđena): z y z M Tako dobven koefcjent komresblnost smjese, z M, uvrstt će se u korgranu oću lnsku jednadžbu stanja: v zrt Prvo se zračunavaju reducran tlak temeratura za obje komonente Rad reglednost, brojev koj se odnose na razlčte komonente označen su drugom bojom: T T r r r r 00, 97, 50,8 K K T 98,5, 05, T 8,4 00,0, 49,7 K K T 98,5, 93 T 54,8 Dobven reducran arametr za ojedne komonente mogu oslužt za očtavanje vrjednost z z odgovarajućh grafčkh l tablčnh korelacja 68
73 Prmjent će se grafčka korelacja, slčna onoj Standngovoj (STANDING, 94) Graf je rkazan na slc 0 Slka 0 Koefcjent komresblnost kao funkcja reducranog tlaka temerature Zelenom bojom rkazano je očtavanje koefcjenta komresblnost za eten, a lavom za ksk Crvenom bojom rkazano je očtavanje za smjesu, zadatak B) Očtan koefcjent komresblnost z grafčkog rkaza z = f( r,t r ) su: z 0,34, z 0,955 Koefcjent komresblnost smjese tada je: yz zm 0,540,34 0,54 0,955 0,80 Molarn volumen je: zmrt 0,808,3498,5, m 3 mol - v Srednja molarna mase znos: - M ym 0,548,054 0,543,999 30,997 g mol Tražena gustoća je: 69
74 3 M 30, ,4 kg m 4 v,957 0 Alternatvno, kao dvoarametarska korelacja može oslužt tablčna korelacja o Lee- Kesleru (LEE, 975), vd odjeljak 7 Ta je korelacja o svom osnovnom oblku troarametarska: z = f( r,t r,) U rvoj tablc nalaze se koefcjent komresblnost sferčne čestce (argona) kao funkcja: z (0) = f( r,t r ), a u drugoj korekcje usljed nesferčnost: z () = f( r,t r ) Ukun koefcjent komresblnost tada se računa kao:,, z z T z T (06) (0) () r r r r Ovdje će se zanemart korekcja usljed nesferčnost, retostavt će se da vrjed: (0) z z Tr, r (07) Na slc 0 rkazana je odgovarajuća Lee-Keslerova tablca Slka 0 Očtavanje z (0) za redmetne vrjednost r T r z Lee-Keslerovh tablca Zelenom bojom rkazano je očtavanje koefcjenta komresblnost za eten, a lavom za ksk Crvenom bojom rkazano je očtavanje za smjesu, zadatak B) Izračunate vrjednost reducranog tlaka temerature za ojedne komonente nalaze se zmeđu tabelarnh:,000 r, 97,500, Tr, 05, r,0,00, 70
75 ,0 T, 93 r,9 Stoga će se rmjent lnearna nterolacja, gdje je otrebno:,970,33,97,500 z z r r,97 0,3433 0,345 0,33, 000,500,930,9456,93,90 zt zt r r,93 0,9499 0,9599 0,9456, 00,90 Sljed zračunavanje koefcjenta komresblnost smjese: yz, zm 0,540,3433 0,54 0,9499 0,7958 molarnog volumena: zmrt 0,79588,3498,5 v, m mol 00035, srednje molarne mase: - M ym 0,548,054 0,543,999 30,997 g mol, gustoće: 3 M 30, , kg m 4 v, , 04 Rješenje zadatka B) Smjesa se sastoj od dvju komonenata: eten() ksk() Temeratura tlak su zadan: T 5 C=98,5 K, 00 atm, a zadan je sastav lnske smjese: y 0, 54 Kayevo ravlo za zračunavanje seudokrtčne temerature reuzel su Prausntz Gunn: T KM yt K Prausntz-Gunnovo ravlo za seudokrtčn tlak, jednadžba (04), nasat će se na jednostavnj načn: z RT KM KM KM, vkm 7
76 r čemu se rad jednostavnost lakšeg razumjevanja uvode ojmov seudokrtčnog molarnog volumena: v KM yv, K te seudokrtčnog koefcjenta komresblnost: z KM y z K Nakon uvrštavanja brojčanh vrjednost dobje se: 3 v KM 0,5430,4 0,54 73,4 87,878 cm mol, TKM 0,548,9 0,54 54,8 87,33 K, zkm 0,540,80 0,54 0,88 0,86, 0,868,3487,33 5, 0686 MPa 87,8780 KM 6 Izračunavaju se reducran tlak temeratura Redukcja se rovod uravo zračunatm seudokrtčnm tlakom, odnosno temeraturom: T 00035,00, rm 6 KM 5,06860 rm T 98,5,597,6 T 87,33 KM Na osnov grafčke korelacje z = f( r,t r ), slčne Standngovoj očta se (vd slku 0) sljedeć koefcjent komresblnost: zm 0,89, što daje još : zmrt 0,898,3498,5 v,7730 m mol M ym 0,54 8,054 0,54 3,999 30,997 g mol, 3 M 30, ,4 kg m 4 v,7730 Na osnov tablčne korelacje z = z (0) =f( r,t r ) rema Lee-Kesleru očta se (vd slku 0): zm 0,8738, dalje: zmrt 0,87388,3498,5 v,80 m mol 00035, 4 3 -, M - ym 0,54 8,054 0,54 3,999 30,997 g mol, 7
77 3 M 30, ,0 kg m 4 v, Komentar rješenja Na četr razlčta načna dobvene su četr razlčte vrjednost za gustoću lnske smjese Samo usoredba s eksermentalnm odacma može okazat koja je od njh najbolja Iak, može se reć da je ostuak osan u zadatku A) nermjeren te da će rstu reko seudokrtčnh arametara, zadatak B), dat u ravlu bolje rezultate 06 Lteratura Izvor: Robert C Red, John M Prausntz, Thomas K Sherwood, The Proertes of Gases and Lquds, 3 zd, Mc Graw Hll, New York, 977 str 74 Posebna lteratura: (KAY, 936) W B Kay, Densty of Hydrocarbon Gases and Vaors at Hgh Pressure and Temerature, Industral and Engneerng Chemstry Research, 8 (936) (LEE, 975) Byung Ik Lee, Mchael G Kesler, A Generalzed Thermodynamc Correlaton Based on Three- Parameter Corresondng States, Amercan Insttute of Chemcal Engneers Journal (975) (PRAUSNITZ, 958) John M Prausntz, R D Gunn, Volumetrc Proertes of Nonolar Gaseous Mxtures, Amercan Insttute of Chemcal Engneers Journal 4 (958) (STANDING, 94) Marshall B Standng, Donald L Katz, Densty of Natural Gases, Amercan Insttute of Mnng, Metallurgcal and Petroleum Engneers Transactons, 46 (94)
78 Equaton Secton Volumen realne lnske smjese Procjent koefcjent komresblnost molarn volumen ekvmolarne smjese CO etana r temeratur od 50 K tlaku od 0 atm Pretostavt da se lnska smjesa r tm uvjetma vlada rema Soave-Redlch-Kwongovom modelu Parametre smjese zračunat rmjenom ravla mješanja, a olnomn oblk funkcje, z = f(z), rješt Newton-Gossetovm ostukom Uz ukrštene arametre k = k = 0,, otrebn odac još su: T K /K K /atm CO () 304, 73,8 0,5 etan() 305,4 48,8 0,099 Oća razmatranja o zadatku Ugljčn doksd etan su komonente s krtčnm temeraturama nešto znad sobne Zadana temeratura od 50 K ovšen tlak od 0 atm ukazuju na to da će Soave-Redlch-Kwongov olnom trećeg stunja o koefcjentu komresblnost mat tr nul-točke Gossetov ostuak rješavanja olnoma omogućuje odbacvanje srednje nul-točke, koja ne može mat fzčk smsao Najveće najmanje rješenje treba naknadno testrat s obzrom na faznu stablnost Soave-Redlch-Kwongova jednadžba stanja Odjeljak 7 donos sku jednadžb za Soave-Redlch-Kwongovu (SRK) jednadžbu stanja (SOAVE, 97) Za ovaj je zadatak otreban olnom trećeg stunja o koefcjentu komresblnost z: 3 z z A B B z AB 0, () uz: a A, () R T b B, (3) RT R T a K a, (4) b K RT b K (5) K a ,47480, (6) b 0, , (7) 3 74
79 T r, (8) 0, 48508,557 0,563 (9) Jednadžba zahtjeva oznavanje krtčne temerature tlaka, T K odnosno K, te Ptzerovog koefcjenta acentrčnost,, za komonente sustava Buduć da se rad o smjes lnova, otrebno je uzet u obzr tzv ravla mješanja 3 Pravla mješanja za jednadžbu SRK Pravla mješanja omogućavaju zračunavanje arametara jednadžbe stanja za smjesu na osnov oznath arametara ojednh komonenata sastava smjese Izraz za dmenzjske (volumne) arametre jednadžbe stanja SRK su: b B yb, (0) M yb () M y je sastav smjese skazan molarnm udjelom komonente Za dvokomonentnu smjesu zraz glas: bm yb yb () Za nterakcjske se arametre rmjenjuju dvostruke sume: a y y a A, (3) M j j y y A (4) M j j a j A j su tzv ukršten arametr Kod dvokomonentne smjese rass dvostrukh suma glase: a y a y y a y a, (5) M A yayya ya (6) M Kod jednadžbe SRK, zraz za ukrštene arametre su: a k a a j j j, (7) A k AA (8) j j j k j je emrjsk arametar rlagodbe modela eksermentalnm volumetrjskm odacma za smjese 4 Gossetov ostuak rješavanja jednadžb stanja trećeg stunja Postuak teratvnog rješavanja jednadžb stanja trećeg stunja u odručju zasćenja Gosseta suradnka (GOSSET, 986) detaljno je osan u odjeljku 33 Za njegovu rmjenu defnra se olnom trećeg stunja Soave-Redlch-Kwongove jednadžbe stanja: 75
80 3 f( z) z z AB B zab 0, (9) njegova dervacju o koefcjentu komresblnost: 3 f z z z AB B (0) Algortam traženja nul-točk olnoma f(z) je: ncjacja: za kaljevnu: z B za aru: z v/ RT zračunavanje olnoma f(z): f z? ako je f z 0 roračun završava 3 zračunavanje dervacje olnoma f'(z): z? f rmjent Newtonovu formulu: ako je f z 0 ako je f z 0 z z f z z f vratt se na točku rmjent z z za aru, odnosno z 0,3z za kaljevnu vratt se na točku 5 Rješenje zadatka Za smjesu: CO () etan(), zadan su tlak temeratura: T 50 K, 0 atm=,0350 MPa, te sastav smjese reko molarnh udjela (ekvmolarna smjesa znač jednake kolčne tvar komonenata): y y 0,5 Parametr a b ojednačnh fluda (označen razlčtm bojama) su: RT a K 0, 47488,34 304, a 0,3657, 73,8 035 b K RT b 0,086648,34304, K K 73,8 035 a K,93 0 RT a K 0, 47488,34 305, 4 0,5574, 48,8035 5, 76
81 b RT b 0,086648,34305,4 K K 48,8035 Jednce su rad jednostavnost suštene Reducrane temerature ojednh fluda su: T T r r T 50 0,88, T 304, K T 50 0,886 T 305,4 K Parametr su: 0, 48508,557 0,563 4, , 48508,5570, 5 0,5630, 5 0,863 0, 48508,557 0,563 0, 48508,5570, 099 0,5630, 099 0,63769 Sljed zračunavanje arametara ojednačnh fluda: T r, 0,863 0,88,604 T r 0, ,886,47 Izraz za ravla mješanja su: a a 0,3657,604 0,444, a a 0,5574,47 0,669, a k a a, 0, 0,4440,669 0,464 a y y a M 0, 5 0,444 0,5 0,5 0,464 0,5 0, 4949 j j j y a y y a y a 5, 0,669, 77
82 b M yb 5 5 yb yb 0,5,930 0,54, ,68950 Parametr A B smjese su: M a 0, A 0,60, RT 8, , bm B 0,080 RT 8,34 50 Za ostuak o Gossetu, defnra se olnom trećeg stunja o koefcjentu komresblnost za jednadžbu SRK te njegova dervacja o z: 3 f z z z AB B z AB 3 f z z z AB B Početne retostavke za arnu, odnosno kaljevtu fazu su: V L z z B Detalj ostuka teracje su u 7 zadatku Ovdje se rkazuju samo međurješenja: V0 z = 0 z =0,08 V z =0,998 L z =0, V L z =0,8943 z =0, V3 L3 z =0,8937 z =0, V4 z =0,8937 L4 z =0, V5 z =0,8937 L5 z =0, Molarn volumen are (V) kaljevne (L) su: v v z RT 0,8937 8,3450, m mol, 0350 V V 3 3 z RT 0, ,3450 6,38 0 m mol 0350 L L 5 3 Na slc rkazana je teracja Newtonovom metodom tangente rema konačnm rješenjma 78
83 fz ( ) 0,5 0,0 0,05-0, 0, 0,4 0,6 0,8,0-0,05 z 0, 0,0 fz ( ) 0,08 0,06 0,04 0,0 0,000 fz ( ) 0,90 0,9 0,94 0,96 0,98,00,0 z - 0,000-0,0004 0,05 0,00 0,05 0,030 0,035 0,040 z - 0,0006-0,0008-0,000-0,00 Slka Ilustracja teratvnog ostuka rješavanja Soave-Redlch-Kwongove jednadžbe stanja u oblku olnoma trećeg stunja, metodom o Gossetu (Newtonova metoda tangente) Na gornjoj slc jasno se vd cjel olnom trećeg stunja z = f(z) s tr nul-točke Srednja slka uvećano okazuje teracju do rješenja za koefcjent komresblnost are, a donja slka do rješenja za koefcjent komresblnost kaljevne 6 Komentar rješenja Dvje dobvene vrjednost za ravnotežne molarne volumene are kaljevne još uvjek ne znače da su u sustavu rsutne dvje faze u ravnotež Za konačne zaključke otrebno je na osnov dobvenh rješenja zračunat još arcjalne koefcjente fugactvnost komonenata Stablna faza bt će ona u kojoj su zračunat arcjaln koefcjent fugactvnost nž Ukolko je arcjaln koefcjent fugactvnost vš u jednoj faz za jednu komonentu, a u drugoj faz za drugu, sustav je u stanju ravnoteže ara-kaljevna otrebno je rovest dodatne roračuna da b se odredl ravnotežn sastav faza, što nje redmet ovoga zadatka 79
84 7 Lteratura Izvor: Stanley M Walas, Phase Equlbra n Chemcal Engneerng, Butterworth Publshers, Boston, 985 Posebna lteratura: (GOSSET, 986) Robert Gosset, Georges Heyen, Bors Kaltventzeff, An Effcent Algorthm to Solve Cubc Equatons of State, Flud Phase Equlbra 5 (986) 5 64 (SOAVE, 97) Gorgo Soave, Equlbrum Constants from a Modfed Redlch-Kwong Equaton of State, Chemcal Engneerng Scence 7 (97)
85 Equaton Secton Temeratura realne lnske smjese Izračunat temeraturu smjese kska() etena() sastava y = 0,75 r tlaku od 00 atm, uz retostavku da se lnska smjesa vlada rema Redlch-Kwongovom modelu Molarn volumen smjese r tm uvjetma znos v =,540-4 m 3 mol - Pseudokrtčne arametre smjese zračunat rema Kayevom Prausntz-Gunnovom ravlu Temeraturu računat ostukom drektne teracje Termodnamčk arametr čsth tvar su: T K /K v k /cm 3 mol - z k ksk() 54,8 73,4 0,88 eten() 8,4 30,4 0,80 Oća razmatranja o zadatku Prkazan zadatak vrlo je slčan 5 B) zadatku Razlka je jedno u tome što se ovdje rad o lnskoj smjes Redlch-Kwongova jednadžba stanja Iz Redlch-Kwongove jednadžbe stanja (REDLICH, 949) rkazuju se samo zraz koj su btn za rješavanje ovoga zadatka To je oć zraz jednadžbe stanja koj ovezuje tlak (, ekslctno), temeraturu, T, molarn volumen, v RT a v b Tv v b () Parametr jednadžbe stanja zračunavaju se z krtčnh arametara, tlaka, K, odnosno temerature, T K, rema: 5 R T a K a, () b K RT b K (3) K Koefcjent a b su: a 0,47480, (4) b 0, (5) 3 8
86 3 Pseudokrtčn arametr Pseudokrtčn arametr služe za reducranje temeratura tlakova lnskh smjesa Najčešće se rmjenjuje sku ravla rema Prausntzu Gunnu (PRAUSNITZ, 958) Jednostavnja, manje točna varjanta th ravla korst sljedeće jednadžbe: T KM KM yt, (6) K yzk yv M RT K KM (7) y (8) M ovdje označavaju Ptzerov koefcjent acentrčnost za smjesu, odnosno komonentu 4 Metoda drektne teracje za zračunavanje temerature Metoda drektne teracje osana je sasvm oćento u odjeljku 3 Prema toj metod, Redlch-Kwongovu jednadžbu (5) r računanju temerature treba rkazat u oblku: T f T, (9) odnosno: v b a T, (0) R Tvvb čme se konstrura osnovna jednadžba teracje: T v b a, () R T vv b 5 Rješenje zadatka Zadatkom je zadana smjesa kska() etena() Molarn volumen smjese je: v 4 3,54 0 m mol, tlak znos: 00 atm 0,0350 MPa Sastav smjese defnran je molarnm udjelom kska: y 0,75 Prvo je otrebno zračunat seudokrtčne arametre Pomoćne varjable su: 3 v KM 0,7573,4 0,75 30,4 87,65 cm mol, zkm 0,750,88 0,75 0,80 0,86 8
87 Pseudokrtčna temeratura je: TKM 0,7554,8 0,75 8, 4 86,7 K, a seudokrtčn tlak: 0,868,3486,7 5, MPa 87,650 KM 6 Izračunat T KM KM tada služe za računanje arametara jednadžbe stanja Redlcha Kwonga za smjesu: a b RT a 0, 47488,34 86,7, 7786,,5,5 KM M 6 KM 5, RT b 0,086648,3486,7,6550 KM M 6 KM 5, Za ncjacju temeraturne teracje oslužt će jednadžba stanja dealnog lna Kad b se ln vladao dealno, njegova temeratura bla b: 4 v 00035,540 T0 309,56 K R 8,34 Iteracja o temeratur odvja se o formul: T v b a M M R T v v b M U rvom se koraku dobje, nakon uvrštavanja: 4 5,540,6550, 7786 T ,34 309,56,540,540, 6550 Brojev označen crvenom, odnosno zelenom bojom, onavljaju se z teracje u teracju, a h je rkladno zasebno zračunat: 7 5, , T 309, 56 Rezultat je: T 337,8 K Sljed drug korak: T 7, ,899 60, 337, 8 5 T 335,3 K, dalje: 5 83
88 T3 335,45 K, T4 335,44 K, što je konačan rezultat Na slc grafčk je rkazana teracja do konačnog rješenja: 360 ft ( ) T ft ( ) 335, ,50 335,45 335,40 335,35 335, Slka Ilustracja zračunavanja temerature rema Redlch-Kwongovoj jednadžb stanja metodom drektne teracje Na gornjoj slc vd se očetak karakterstčnog sralnog rblžavanja rješenju koje se dobje kada je f(t) negatvnoga nagba Na donjoj slc rkazano je uvećano temeraturno odručje u neosrednoj blzn točke rješenja T 84
89 6 Iteracjske formule za druge jednadžbe stanja Za jednadžbu stanja o Soave-Redlch-Kwongu, teracjska formula je: T v b a, () R vv b uz: : T T K, (3) 0, 48508,557 0,563 (4) Bojama su označen smbol koj se onavljaju u teracjama Slčno za jednadžbu stanja o Pengu Robnsonu vrjed: T v b a R v bvb, (5) T T K, (6) 0,37464,546 0, 699 (7) 7 Lteratura Izvor: Stanley M Walas, Phase Equlbra n Chemcal Engneerng, Butterworth Publshers, Boston, 985 Leonard C Labowtz, John S Arents, Physcal Chemstry Problems and Solutons, Academc Press, New York, 969, str 74 Posebna lteratura: (PRAUSNITZ, 958) John M Prausntz, R D Gunn, Volumetrc Proertes of Nonolar Gaseous Mxtures, Amercan Insttute of Chemcal Engneers Journal 4 (958) (REDLICH, 949) Otto Redlch, Joseh NS Kwong, On The Thermodynamcs of Solutons, Chemcal Revews 44 (949)
90 Equaton Secton 33 Tlak realne lnske smjese Izračunat tlak od kojm se nalaz jedan mol zraka rblžnog sastava y(n ) = 0,79 y(o ) = 0, r temeratur od 98 K, uz retostavku da se zrak vlada rema Redlch- Kwongovom modelu Molarn volumen zraka r tm uvjetma znos v =,480 - m 3 mol - Parametre lnske smjese računat rmjenom ravla mješanja Termodnamčk arametr čsth tvar su: T K /K K /bar dušk() 6, 33,9 ksk() 54,6 50,4 3 Oća razmatranja o zadatku Zadatak je vrlo jednostavan Buduć da je Redlch-Kwongova jednadžba stanja ekslctna o tlaku, otrebno je samo uvrstt zadan volumen temeraturu zračunat tlak Jednu komlkacju može redstavljat zračunavanje svojstava lnske smjese 3 Redlch-Kwongova jednadžba stanja Iz Redlch-Kwongove jednadžbe stanja (REDLICH, 949) rkazuju se zraz otrebn za rješavanje ovoga zadatka To je jednadžba stanja ekslctna o tlaku,, kao funkcja temerature, T, molarnog volumena, v RT a v b Tv v b (3) Parametr jednadžbe stanja zračunavaju se z krtčnog tlaka, K, krtčne temerature, T K : 5 R T a K a, (3) b K RT b K (33) K Koefcjent a b su: a 0,47480, (34) b 0, (35) 3 33 Pravla mješanja Pravla mješanja za jednadžbu stanja o Redlchu Kwongu rkazuju se sljedećm zrazma: a y y a, (36) M j j j 86
91 b l: A B yb, (37) M y y A, (38) M j j j yb (39) M Za dvokomonentnu smjesu vrjed osebno: a a y a y y a y y a y, (30) M a a y a y y a y, (3) M uz: a a, (3) a a a, (33) a (34) Za volumn arametar vrjed: bby by (35) 34 Rješenje zadatka Zadatkom je zadana smjesa duška() kska() Molarn volumen smjese je: v 3,48 0 m mol, temeratura znos: T 98 K Sastav smjese defnran je molarnm udjelom duška (u zraku): y 0,79 Prvo je otrebno zračunat arametre a b za ojednačne komonente Prmjenjuju se razlčte boje za svaku komonentu: RT a 0, 47488,34 6, a,5595,,5,5 K 5 K 33,9 0 RT b 0,086648,346, b,6860 K 5 K 33,9 0 a RT a 0, 47488,34 54, 6, 743,,5,5 K 5 K 50,4 0 5, 87
92 b RT b 0,086648,3454,6,0960 K 5 K 50,40 Sljede jednadžbe ravla mješanja: a aa,5595, 743, 6484, a b M M j y y a j j ya yya ya, 0,79,5595 0,790,, ,,743,597 yb yb yb, ,79, ,, Tlak se zračunava jednostavno rema: RT am v b Tv v b M M, 8,34 98,597,480, , 480,480, , 4 50,58, 99855,66 Pa 5, 35 Lteratura Izvor: Stanley M Walas, Phase Equlbra n Chemcal Engneerng, Butterworth Publshers, Boston, 985 Posebna lteratura: (REDLICH, 949) Otto Redlch, Joseh NS Kwong, On The Thermodynamcs of Solutons, Chemcal Revews 44 (949)
93 Equaton Secton 44 Fugactvnost realne lnske smjese Procjent koefcjente komresblnost fugactvnost ekvmolarne smjese etena() etana() r temeratur od 73 K tlaku od 30 bar Pretostavt da se lnska smjesa r tm uvjetma vlada rema Soave-Redlch-Kwongovom modelu Parametre smjese računat rema ravlma mješanja, a olnomn oblk funkcje z = f(z) rješt Newton-Gossetovm ostukom Provjert fazno odručje, odnosno otvrdt stablnost faza Ukršten arametar k = 0 za smjese ugljkovodka, a termodnamčk arametr čsth tvar su: T K /K K /atm eten() 8,4 50,4 0,089 etan() 305,4 48,8 0,099 4 Oća razmatranja o zadatku Zadana temeratura nešto je sod krtčnh temeratura komonenata može se retostavt da navedena smjesa može r toj temeratur ostojat kao kaljevna kao ara, al kao smjesa are kaljevne, ovsno o sastavu tlaku Dakle, očekuje se da će Soave-Redlch- Kwongov olnom trećeg stunja r takvm uvjetma dat tr matematčk realna rješenja za molarn volumen, odnosno koefcjent komresblnost Srednje rješenje nema fzčkog smsla, a najmanje najveće treba testrat s obzrom na faznu stablnost Buduć da se rad o smjes, rješavanje zadatka treba zaočet rocjenom arametara smjese 4 Soave-Redlch-Kwongova jednadžba stanja Soave-Redlch-Kwongova jednadžba (SRK) (SOAVE, 97) je jedna od najčešće rmjenjvanh jednadžb stanja u naftnoj etrokemjskoj ndustrj Prkazat će se karakterstčn zraz za tu jednadžbu otrebn za rješavanje zadatka Polnom trećeg stunja o koefcjentu komresblnost z za jednadžbu stanja SRK glas: b b a ab RT RT RT RT Krać zas toga zraza je: 3 z z z z z A B B z AB (4) 0 (4) Izraz otrebn za zračunavanje zadatka ovezuju arametre jednadžbe stanja s makroskoskm arametrma čsth tvar: a A, (43) R T b B, (44) RT 89
94 R T a K a, (45) b K RT b K (46) K a ,47480, (47) b 0, , (48) 3 T r, (49) 0, 48508,557 0,563 (40) 43 Pravla mješanja za jednadžbu SRK Pravla mješanja za dmenzjske (volumne) arametre jednadžbe stanja SRK su: b B yb, (4) M yb (4) M y je sastav smjese skazan molarnm udjelom komonente Za dvokomonentnu smjesu zraz glas: bm yb yb (43) Interakcjsk su arametr: a y y a A, (44) M j j y y A (45) M j j a j A j su tzv ukršten arametr Kod dvokomonentne smjese rass dvostrukh suma glase: a y a y y a y a, (46) M A y A y y A y A (47) M Kod jednadžbe SRK, zraz za ukrštene arametre su: a k a a j j j, (48) A k AA (49) j j j k j je emrjsk arametar rlagodbe modela eksermentalnm volumetrjskm odacma za smjese U ovom slučaju zadatkom je zadano k = 0 90
95 44 Gossetov ostuak rješavanja jednadžb stanja trećeg stunja Postuak Roberta Gosseta suradnka (GOSSET, 986) za teratvno rješavanje jednadžb stanja trećeg stunja u odručju zasćenja rkazan je detaljno u odjeljku 33 Polnom trećeg stunja o koefcjentu komresblnost za Soave-Redlch-Kwongovu jednadžbu stanja glas: 3 f( z) z z AB B zab 0, (40) a njegova dervacja o z je: 3 f z z z AB B (4) Proračun traženja nul-točk olnoma f(z) rovod se sljedećm algortmom: ncjacja: za kaljevnu: z B za aru: z v/ RT zračunavanje olnoma f(z): f z 0 ako je f z? roračun završava 3 zračunavanje dervacje olnoma f'(z): z? f f z rmjent Newtonovu formulu: ako je 0 z z f z z f vratt se na točku f z rmjent z z za aru, odnosno z 0,3z za kaljevnu vratt se na točku ako je 0 45 Fugactvnost O defncj fugactvnost njenoj vez s volumetrjskm svojstvma jednadžbama stanja vše je rečeno u odjeljcma Fugactvnost se z jednadžb stanja računaju na osnov rethodno zračunath vrjednost molarnh volumena, odnosno koefcjenata komresblnost Za čste tvar, usoredbom zračunath fugactvnost l koefcjenata fugactvnost are kaljevne r zadanom tlaku temeratur moguće je doznat koja je faza stablna ona nže fugactvnost, odnosno nžeg koefcjenta fugactvnost Izraz za računanje koefcjenta fugactvnost na osnov jednadžbe SRK glas: v a T v ln ln ln zln z (4) vb brt vb Fugactvnost se računa rema: f (43) Za smjese lnova treba računat arcjalne koefcjente fugactvnost Za SRK jednadžbu zraz je: 9
96 b ˆ b a b ln ln M M b ln M z z yj a j b M v bmrt b M j v (44) Ukolko su zračunat arcjaln koefcjent fugactvnost svh komonenata nž u jednoj od faza, sustav se u cjelost nalaz u toj faz Međutm, ako su zračunat arcjaln koefcjent fugactvnost djela komonenata nž u arnoj, a djela u kaljevtoj faz, dolaz do razdjeljvanja sustava na dvje faze, r čemu se komonente koncentrraju u faz gdje maju nž arcjaln koefcjent fugactvnost U tom se slučaju zaravo rad o roračunu ravnoteže ara kaljevna, što nje redmet zračunavanja u ovom zadatku 46 Rješenje zadatka Zadatkom je zadana smjesa etena() etana() Tlak smjese je: 30 bar, temeratura znos: T 73 K Sastav smjese je ekvmolaran: y y 0,5 Prvo se računaju arametr a b komonenata: RT a K 0, 47488,34 8, 4 a 0, 46443, 50,4035 b K RT b 0,086648,348,4 3, K K 50, ,48508,557 0,563 0,48508,5570,089 0,5630,089 0, Tr 0,6945,0099 8,4, a b RT a 0, 47488,34 305, 4 0,55736, K 5 K 48,8 0 RT b 0,086648,34305,4 4, K 5 K 48,8 0 0, 48508,557 0,563 0, 48508,5570,099 0,5630,099 0, Tr 0,63769, ,4 5, 5,, 9
97 Jednce su suštene rad jednostavnost, a razlčte komonente rkazane su razlčtm bojama Sljede jednadžbe ravla mješanja: a k a a 0, 46443, 0 0,557, ,53039 a y y a b M M j j j 0, 46443, ,50, , , y a y y a y a 0,5 0, 0, 0,53093 yb yb yb 4, ,53, ,54, Jednadžba stanja trećeg stunja o Soave-Redlch-Kwongu je: 3 z z A B B z AB 0 Sljed, dakle, zračunavanje vrjednost A B z skraćenog zasa olnoma trećeg stunja o koefcjentu komresblnost, ovaj ut za smjesu: A B 5 a 0, ,309859, RT 8,34 73 M M b RT 4, , M M 0, Za roračun arne faze, kao ncjacja Gossetova ostuka, odnosno Newtonove metode tangente, služ koefcjent komresblnost dealnog lna: 0 v z RT Formule za teracju su: 3 f z z z AB B z AB, 3 f z z z AB B, z f z z f z Rješenja dobvena ojednm teracjama su: z 0,8346, 93
98 z 0, , 3 z 0, 66677, 4 z 0, 65896, 5 z 0, , 6 z 0, Za roračun kaljevte faze, kao ncjacja Gossetova ostuka, odnosno Newtonove metode tangente, služ vrjednost B M : 0 z B M 0, Formule za teracju su ste kao za arnu fazu, a rezultat ojednh teracja su z 0, , z 0,370, 3 z 0,6643, 4 z 0,6739, 5 z 0,6739 Na slc 4 rkazana je konvergencja Newtonove metode do rješenja: fz ( ) 0,3 0, 0, - 0, 0, 0,4 0,6 0,8,0-0, z Slka 4 a) Ilustracja teratvnog ostuka rješavanja Soave-Redlch-Kwongove jednadžbe stanja u oblku olnoma trećeg stunja, metodom o Gossetu (Newtonova metoda tangente) 94
99 fz ( ) 0,08 0,0 0, 0,4 z - 0,00-0,004-0,006 Slka 4 b) Ilustracja teratvnog ostuka rješavanja Soave-Redlch-Kwongove jednadžbe stanja u oblku olnoma trećeg stunja, metodom o Gossetu (Newtonova metoda tangente) Rad boljeg rkaza kaljevte faze umanjeno je odručje na ascs (Potencjaln) molarn volumen arne faze tada je jednostavno, z korgrane oće lnske jednadžbe: z RT 0, ,3473 v 300 a koefcjent fugactvnost znos: V V 4 3 4,98360 m mol 5 v a v ln ln ln ln V V V M V V z V V z v bm bmrt v bm,, V ln 4 4,98360 ln 4, , , ,98360 ln 4, 660 8,3473, 4, , , ln 0, , V ln 0, 86983, V 0, Molarn volumen kaljevne je: v z RT 0,67398, L L 5 3 8,8390 m mol 5 Koefcjent fugactvnost je: v a v ln ln ln ln L L L M L L z L L z v bm bmrt v bm, 95
100 L ln 5 8,8390 ln 8,8390 4, , ,8390 ln 4, 660 8,3473, 8,8390 4, ,6739 ln 0,6739, L ln 0, 56535, L 0, Komentar rješenja fazna stablnost Na temelju nžega koefcjenta fugactvnost čn se da se sustav nalaz u stanju are Treba, međutm, još rovjert arcjalne koefcjente fugactvnost komonenata u objema fazama: V b V V M M M ˆ b a b b ln z ln z y V a ya ln V b M v, bmrt b M v V b V V M M M ˆ b a b b ln z ln z y V a ya ln V b M v, bmrt b M v L b L L M M M ˆ b a b b ln z ln z y L a ya ln L b M v, bmrt b M v L b L L M M M ˆ b a b b ln z ln z y L a ya ln L b M v bmrt b M v Rezultat su: ln ˆ 0, 3976 ˆ 0, 78686, V V ln ˆ 0,33406 ˆ 0, 75906, V V ln ˆ 0, 074 ˆ 0,93089, L L ln ˆ 0, 4467 ˆ 0, 6496 L L Komonenta (eten) ma nž koefcjent fugactvnost u arnoj faz tamo se koncentrra, dok komonenta (etan) ma nž koefcjent komresblnost u kaljevtoj faz gdje se koncentrra Dakle, u sustavu su rsutne obje faze; sastav faza razlkuju se, jer etena ma vše u arnoj, a etana u kaljevtoj faz Točn sastav faza zračunavaju se rkladnm algortmom tzv zotermno zobarnog flasha (jednokratnog saravanja) 96
101 48 Lteratura Izvor: Stanley M Walas, Phase Equlbra n Chemcal Engneerng, Butterworth Publshers, Boston, 985 Posebna lteratura: (GOSSET, 986) Robert Gosset, Georges Heyen, Bors Kaltventzeff, An Effcent Algorthm to Solve Cubc Equatons of State, Flud Phase Equlbra 5 (986) 5 64 (SOAVE, 97) Gorgo Soave, Equlbrum Constants from a Modfed Redlch-Kwong Equaton of State, Chemcal Engneerng Scence 7 (97)
102 Equaton Secton 55 Fugactvnost realne lnske smjese Procjent koefcjente komresblnost fugactvnost ekvmolarne smjese metanola(), etanola() acetona(3) r temeratur od 300 K tlaku od 8 bar Pretostavt da se lnska smjesa r tm uvjetma vlada rema Soave-Redlch-Kwongovom modelu Pseudokrtčne arametre smjese zračunat rema Kayevom Prausntz-Gunnovom ravlu Polnomn oblk funkcje, z = f(z), rješt Newton-Gossetovm ostukom Provjert fazno odručje, odnosno otvrdt stablnost faza Ukršten arametar k = 0 za smjese ugljkovodka, a termodnamčk arametr čsth tvar su: T K /K v K /cm 3 mol - z K metanol() 5,6 8,0 0,4 0,556 etanol() 53,9 67, 0,40 0,644 aceton(3) 508, 09,0 0,3 0,304 5 Oća razmatranja o zadatku Zadatak je vrlo slčan rethodnomu Zadana temeratura (300 K) ovdje je znatno sod krtčnh temeratura svh komonenata K tome, zadana temeratura je nešto znad sobne (oko 7 C), a metanol, etanol aceton su kaljevne r sobnoj temeratur atmosferskom tlaku Buduć da je zadan tlak 8 bar, što je znatno vše od atmosferskog, valja retostavt da će smjesa bt samo u kaljevtom stanju Međutm, Soave-Redlch-Kwongov olnom tada može mat tr matematčk realna rješenja za molarn volumen, odnosno koefcjent komresblnost U slučaju ojave trju matematčk realnh rješenja, treba odredt njhovu faznu stablnost 5 Soave-Redlch-Kwongova jednadžba stanja Jedna od najčešće rmjenjvanh jednadžb stanja u naftnoj etrokemjskoj ndustrj je jednadžba Soave-Redlch-Kwonga (SRK) (SOAVE, 97) je Karakterstčn zraz za tu jednadžbu otrebn za rješavanje zadatka su sljedeć Polnom trećeg stunja o koefcjentu komresblnost z za jednadžbu stanja SRK jest: 3 b b a ab z z z 0, 3 3 RT RT RT RT Odnosno, u kraćem zasu: (5) 3 z z A B B z AB 0 (5) Parametr su: a A, (53) R T b B, (54) RT 98
103 R T a K a, (55) b K RT b K (56) K a ,47480, (57) b 0, , (58) 3 T r, (59) 0, 48508,557 0,563 (50) 53 Pseudokrtčn arametr Pseudokrtčna svojstva su seudokrtčn tlak, KM, seudokrtčna temeratura, T KM On služe za reducranje temerature l tlaka kod lnskh smjesa, s cljem rmjene razlčth korelacja za rocjenu volumetrjskh svojstava, s naglaskom na nadkrtčno odručje Dakle, ne rad se strktno o rocjen krtčnh arametara smjese Iak, za smjese blskh vrelšta, zračunat KM T KM neće se btno razlkovat od krtčnh arametara za smjesu Sku jednadžb za zračunavanje seudokrtčnog tlaka temerature, s odstuanjma za neolarne smjese do 5 %, dal su Prausntz Gunn (PRAUSNITZ, 958) Jednostavnja, manje točna varjanta th ravla korst sljedeće jednadžbe: T KM KM yt, (5) K yzk yv M RT K KM (5) y (53) M su Ptzerov koefcjent acentrčnost za smjesu, odnosno komonentu 54 Gossetov ostuak rješavanja jednadžb stanja trećeg stunja Gossetov ostuak za teratvno rješavanje jednadžb stanja trećeg stunja suradnka (GOSSET, 986) detaljno je rkazan u odjeljku 33 Polnom trećeg stunja o koefcjentu komresblnost za Soave-Redlch-Kwongovu jednadžbu stanja jest: 3 f( z) z z AB B zab 0, (54) a njegova dervacja o z je: 3 f z z z AB B (55) 99
104 Proračun traženja nul-točk olnoma f(z) rovod se sljedećm algortmom: ncjacja: za kaljevnu: z B za aru: z v/ RT zračunavanje olnoma f(z): f z? ako je f z 0 roračun završava 3 zračunavanje dervacje olnoma f'(z): z? f rmjent Newtonovu formulu: ako je f z 0 z z f z z f vratt se na točku rmjent z z za aru, odnosno z 0,3z za kaljevnu vratt se na točku ako je f z 0 55 Fugactvnost Fugactvnost njena veza s volumetrjskm svojstvma jednadžbama stanja osan su u odjeljcma Fugactvnost se z jednadžb stanja računaju na osnov rethodno zračunath vrjednost molarnh volumena, odnosno koefcjenata komresblnost Za čste tvar jednadžbu SRK vrjede zraz: v a T v ln ln ln zln z, (56) vb brt vb f (57) Za smjese lnova treba računat arcjalne koefcjente fugactvnost Za SRK jednadžbu zraz je: b ˆ b a b ln ln M M b ln M z z yj a j b M v bmrt b M j v (58) Ukolko su zračunat arcjaln koefcjent fugactvnost svh komonenata nž u jednoj od faza, sustav se u cjelost nalaz u toj faz Međutm, ako su zračunat arcjaln koefcjent fugactvnost djela komonenata nž u arnoj, a djela u kaljevtoj faz, dolaz do razdjeljvanja sustava na dvje faze, r čemu se komonente koncentrraju u faz gdje maju nž arcjaln koefcjent fugactvnost U tom se slučaju zaravo rad o roračunu ravnoteže ara kaljevna, što nje redmet zračunavanja u ovom zadatku 56 Rješenje zadatka Zadatkom je zadana smjesa metanola(), etanola() acetona(3) Tlak smjese je: 8bar, 00
105 temeratura znos: T 300 K Sastav smjese je ekvmolaran: y y y3 0, Kayevo ravlo za zračunavanje seudokrtčne temerature reuzel su Prausntz Gunn: T KM yt K Prausntz-Gunnovo ravlo za seudokrtčn tlak nasat će se na jednostavnj načn: z RT KM KM KM, vkm r čemu se rad jednostavnost lakšeg razumjevanja uvode ojmov seudokrtčnog molarnog volumena: v KM yv, K te seudokrtčnog koefcjenta komresblnost: z KM y z K Nakon uvrštavanja brojčanh vrjednost dobje se: vkm 0, , 0 0, , 0, , 7 3,0 cm mol, TKM 0, , 6 0, ,9 0, , 5,533 K, zkm 0, , 4 0, , 40 0, , 3 0,3, 0,38,345,533 KM 5,9907 MPa 6 64,7 0 Parametr jednadžbe stanja za smjesu mogu se zračunat rema: a b RT a 0,474808,34 5,533, 9064, KM M 6 KM 5,99075, RT b 0, ,345,533 6,50690 KM M 6 KM 5,99070 Rad jednostavnost suštene su jednce Za ovaj zadatak ravlom mješanja otrebno je zračunat još Ptzerov koefcjent acentrčnost smjese: y, M M 0, ,556 0, , 644 0, ,304 0,50333 Izračunava se za smjesu: 0,48508,557 0,563 M M M 0,48508,5570, , ,37 5, 0, 6 0
106 I zatm još za smjesu: T M M r T M T KM 300, 376, ,533 Jednadžba stanja trećeg stunja o Soave-Redlch-Kwongu je: 3 z z A B B z AB 0 Sljed, dakle, zračunavanje vrjednost A B z skraćenog zasa olnoma trećeg stunja o koefcjentu komresblnost: A B 5 a,9064, ,74733, RT 8, M M M b RT 6, , M M 0,09780 Za roračun arne faze, kao ncjacja Gossetova ostuka, odnosno Newtonove metode tangente, služ koefcjent komresblnost dealnog lna: 0 v z RT Formule za teracju su: 3 f z z z AB B z AB, 3 f z z z AB B, z f z z f z Rješenja dobvena ojednm teracjama su: z 0,80377, z 0, 67855, 3 z 0, 60953, 4 z 0,578054, 5 z 0,57044, 6 z 0,569954, 7 z 0,
107 Za roračun kaljevte faze, kao ncjacja Gossetova ostuka, odnosno Newtonove metode tangente, služ vrjednost B M : 0 z B M 0,09780 Formule za teracju su ste kao za arnu fazu, a rezultat ojednh teracja su z 0,0978, z 0, 0336, 3 z 0, Na slc 5 rkazana je konvergencja Newtonove metode do rješenja: fz ( ) 0,3 0, 0, -0, 0, 0,4 0,6 0,8,0 f( z) -0, 0,09 0,00 0,0 0,0 0,03 0,04 z -0,000-0,0004 z -0,0006-0,0008-0,000 Slka 5 Ilustracja teratvnog ostuka rješavanja Soave-Redlch-Kwongove jednadžbe stanja u oblku olnoma trećeg stunja, metodom o Gossetu (Newtonova metoda tangente) Na slc gore rkazano je cjelo odručje z, a na slc dolje rad boljeg rkaza kaljevte faze umanjeno je odručje na ascs Molarn volumen arne faze tada je jednostavno, z korgrane oće lnske jednadžbe: v z RT 0,569958,34300, m mol 80 V V a koefcjent fugactvnost znos: v a v ln ln ln ln V V V M M V V z V V z v bm bmrt v bm,, 03
108 V ln 3, ln, , , 9064, 6553, ln 6, , 34300, , ,56995 ln 0,56995,, V ln 0,30649 V 0, Molarn volumen kaljevne je: v z RT 0,033848, L L 5 3 7, m mol 5 Koefcjent fugactvnost je: v a v ln ln ln ln L L L M M L L z L L z v bm bmrt v bm, L ln 5 7, ln 7, , , 9064, , ln 6, , , , , ln 0, 03384, L ln 3,88450, L 0, Komentar rješenja fazna stablnost Na temelju znatno nžega koefcjenta fugactvnost skustva u radu s navedenm komonentama s ouzdanjem se može reć da se sustav nalaz u stanju kaljevne Provjera arcjalnh koefcjenata komresblnost komonenata u objema fazama ovdje nje korektna, jer su odgovarajuć zraz za njhovo zračunavanje, vd odjeljak 47, zveden na osnov ravla mješanja, koja ovdje nsu korštena za rocjenu svojstava smjese Lteratura ne donos zraze za zračunavanje arcjalnh koefcjenata fugactvnost komonenata na osnov seudokrtčnh arametara 04
109 58 Lteratura Izvor: Stanley M Walas, Phase Equlbra n Chemcal Engneerng, Butterworth Publshers, Boston, 985 Leonard C Labowtz, John S Arents, Physcal Chemstry Problems and Solutons, Academc Press, New York, 969, str 74 Posebna lteratura: (GOSSET, 986) Robert Gosset, Georges Heyen, Bors Kaltventzeff, An Effcent Algorthm to Solve Cubc Equatons of State, Flud Phase Equlbra 5 (986) 5 64 (PRAUSNITZ, 958) John M Prausntz, R D Gunn, Volumetrc Proertes of Nonolar Gaseous Mxtures, Amercan Insttute of Chemcal Engneers Journal 4 (958) (SOAVE, 97) Gorgo Soave, Equlbrum Constants from a Modfed Redlch-Kwong Equaton of State, Chemcal Engneerng Scence 7 (97)
110 6 Krtčn molarn volumen Veteré Procjent krtčn molarn volumen zobutanola Veteréovm ostukom, na osnov rasoložvh strukturno-grunh arametara: GRUPA Δv M Δv M -CH 3 3,360 5,03 50,50 -CH 3,360 4,03 47,4 -CH 3,360 3,0 43,75 -OH 0,704 7,0,98 6 Oća razmatranja o zadatku Eksermentalna termodnamka zbog svoje zahtjevnost često nje mogla ratt otrebe kemjsko-nženjerskh roračuna za termodnamčkm odacma Problem se često rješavao metodama strukturno-grunh dornosa za rocjenu termodnamčkh svojstava Rad se, name o metodama gdje se određena termodnamčka svojstva (osebce organskh) tvar rocjenjuju na osnov svojstava strukturnh grua koje sačnjavaju molekule romatrane tvar Nr, termodnamčko svojstvo etanola može se rocjent na osnov tabelranh arametara (dornosa) za strukturne grue CH 3, CH OH rkladne formule Naravno, zračunavanje tabelranje dornosa rovod se rema dostunm eksermentalnm odacma Ovm je rstuom načelno moguće, s većom l manjom točnošću, rocjent termodnamčka svojstva još neostojećh l čak hotetskh tvar Prmjer jedne takve metode je hstorjska metoda za rocjenu krtčnog molarnog volumena o Veteréu (VETERÉ, 976) Eksermentaln odac za krtčn molarn volumen zobutanola dostun su u kemjsko-nženjerskm rručncma, nr (POLING, 976) 6 Rješenje zadatka Emrjska Veteréova relacja za krtčn molarn volumen glas: v K n = 33,04 + Δ =,09 ( vm ) (6) Strukturna formula zobutanola je: CH 3 CH 3 CH CH OH Sastoj se, dakle, od dvje CH 3, jedne CH, jedne CH jedne OH skune Uvrštavanjem brojčanh vrjednost dobva se: n ( Δ vm ) = 50, ,4 + 43, 75 +,98 = 03,87, = te zatm: 06
111 ( ), v K = 33, ,87 = 70,9 cm mol 63 Komentar rješenja Pr rmjen ove slčnh korelacja treba vodt računa o barem dvje stvar Prvo, treba oznavat načelo odjele molekula u strukturne grue, koje se može razlkovat od korelacje do korelacje Najbolje je rtom konzultrat orgnalnu lteraturu Drugo, emrjske korelacje rkazanog ta s nedeklarranm jedncama koefcjenata, odnosno eksonenata, zahtjevaju uvrštavanje brojčane vrjednost u točno određenm jedncama I one se razlkuju od korelacje do korelacje, osebce u starjoj lteratur, a je onovo najbolje konzultrat zvorne radove Eksermentaln odatak o krtčnom molarnom volumenu zobutanola je: 3 - v K = 73 cm mol Odstuanje rocjene znos 0,77 % 64 Lteratura Izvor: Robert C Red, John M Prausntz, Thomas K Sherwood, The Proertes of Gases and Lquds, 3 zd, Mc Graw Hll, New York, 977 str 9 Posebna lteratura: (POLING, 000) Bruce E Polng, John M Prausntz, John P O'Connell, The Proertes of Gases and Lquds, McGraw-Hll, New York, 000 (VETERÉ, 967) Alessandro Veteré, An Emrcal Method for Evaluatng Crtcal Molar Volumes, Amercan Insttute of Chemcal Engneers Journal (976)
112 Equaton Secton 77 Koefcjent acentrčnost Edmster; Lee Kessler Procjent koefcjent acentrčnost n-oktana: a) Edmsterovm ostukom b) Lee-Keslerovom relacjom, na osnov sljedećh termodnamčkh odataka: Potrebn odac su: T K = 568,8 K; T V = 398,8 K; K = 4,5 atm 7 Ptzerov koefcjent acentrčnost Ptzerov koefcjent acentrčnost važan je arametar koj se rmjenjuje u troarametarskm korelacjama za rocjenu termodnamčkh svojstava fluda Ptzer je (PITZER, 955) rmjeto da se nagb krvulja saravanja realnh fluda u reducranom r -T r -djagramu za lnove sferno-smetrčnh čestca odudara, te da ostoje odstuanja nagba koja se mogu ovezat s odstuanjma oblka čestca od sferne smetrje, slka 7,0 r 0,8 voda n-butanol 0,6 0,4 metan n-butan n-oktan argon krton etanol 0, 0 0,5 0,6 0,7 0,8 0,9,0 T r Slka 7 Krvulje saravanja realnh fluda u reducranom -T-djagramu Krvulje saravanja lementh lnova se reklaaju U nzu ugljkovodka odstuanje od referentne krvulje za lemente lnove to je veće što je molekula zduženja U skun olarnh tvar, osm geometrje čestce važnu ulogu ma olarnost čestce, odnosno asmetrja u rasodjel gustoće naboja elektronskog oblaka Prkaz ste ovsnost u log r -(/T r )-djagramu, slka 7, omogućuje da se jednm arametrom oše nagb krvulje saravanja Na osnov eksermentalnog odatka o reducranom ravnotežnom tlaku saravanja, r, r reducranoj ravnotežnoj temeratur od T r = 0,7 zračunava se tzv Ptzerov koefcjent acentrčnost: r T r 0,7 log (7) Ako se ne rasolaže odacma za Ptzerov koefcjent acentrčnost željenog fluda, otrebno ga je rocjent z dostunh odataka 08
113 log r -0,5,0,,,3,4,5,6,7,8 0 T r =0,7 / Tr -,0 argon krton -,5 -,0 metan n-butan n-oktan -,5 voda n-butanol etanol -3,0 Slka 7 Krvulje saravanja realnh fluda u log r -/T r -djagramu Pr reducranoj temeratur od T r = 0,7, log r znos za lemente lnove 7 Rješenje zadatka Edmsterovm ostukom Edmsterov se ostuak zasnva na čnjenca da je eksermentalno uno lakše odredt normalno vrelšte fluda, T V, r atmosferskom tlaku nego reducran ravnotežn tlak saravanja r zadanoj reducranoj temeratur: r (T r = 0,7) Edmster je redložo (EDMISTER, 986) sljedeću emrjsku korelacju: 3 log K 7 atm, (7) TV / K T / K (73) K Buduć da se rad o emrjskoj korelacj, jasno su označene jednce u kojma je otrebno uvrštavat krtčn tlak, krtčnu temeraturu te temeraturu normalnog vrelšta Prvo se zračunava reducrana temeratura normalnog vrelšta: Tv / K 398,8 0,70 T / K 568,8, k a zatm Ptzerov koefcjent acentrčnost: 3 0,70 log 4,5 0, , 70 09
114 73 Rješenje zadatka Lee-Keslerovm ostukom Lee Kesler (LEE, 975) su razradl ostuak rocjene termodnamčkh svojstava čsth smjesa fluda na osnov oznavanja krtčne temerature, krtčnog tlaka Ptzerovog koefcjenta acentrčnost komonenata Za slučaj kada Ptzerov koefcjent acentrčnost nje oznat, a rasolaže se s vrelštem komonente r atmosferskom tlaku, Kesler, Lee Sandler redlažu (KESLER, 979) sljedeću relacju za rocjenu : 6 ln K atm 5,974 6, 09648, 886 ln 0,69347 (74) 6 5, 58 5, , 47ln0, je onovo reducrana temeratura normalnog vrelšta, rema jednadžb (73) Nakon uvrštavanja dobva se: 6 ln 4,5 5,974 6,096480,70,886ln 0,700,693470,70, 6 5,58 5,68750,70 3,47ln 0,700,435770,70 0, Komentar rješenja Kao kod rethodnog zadatka, kod rmjene emrjskh korelacja treba vodt računa o uvrštavanju brojčane vrjednost u točno određenm jedncama Današnja lteratura uglavnom rkazuje korelacje matematčk korektno, navodeć jednce tamo gdje je otrebno (nr K /atm), no u starjoj lteratur to nje uvjek bo slučaj Eksermentaln odatak o Ptzerovom koefcjentu acentrčnost n-oktana (POLING, 000) je: 0,394 Odstuanje rocjena znos 0,5 % 75 Lteratura Izvor: Robert C Red, John M Prausntz, Thomas K Sherwood, The Proertes of Gases and Lquds, 3 zd, Mc Graw Hll, New York, 977 str 0 Posebna lteratura: (EDMISTER, 986) Wayne C Edmster, BngJye Lee, Aled Hydrocarbon Thermodynamcs, Gulf Publshng Co, Houston, 986, str 73 (LEE, 975) Byung Ik Lee, Mchael G Kesler, A Generalzed Thermodynamc Correlaton Based on Three- Parameter Corresondng States, Amercan Insttute of Chemcal Engneers Journal (975) (KESLER, 979) Mchael G Kesler, Byung Ik Lee, Stanley I Sandler, Thrd Parameter for Use n Generalzed Thermodynamc Correlatons, Industral and Engneerng Chemstry Fundamentals 8 (979) (PITZER, 955) Kenneth S Ptzer, Davd Z Lman, R F Curl, Jr, Charles M Huggns, Donald E Petersen, The Volumetrc and Thermodynamc Proertes of Fluds II Comressblty Factor, Vaor Pressure and Entroy of Vaorzaton, Journal of the Amercan Chemcal Socety 77 (955) (POLING, 000) Bruce E Polng, John M Prausntz, John P O'Connell, The Proertes of Gases and Lquds, McGraw-Hll, New York, 000 0
115 Equaton Secton 88 Krtčna svojstva Lydersen Procjent krtčna svojstva entafluorotoluena Lydersenovm ostukom Zadan su temeratura normalnog vrelšta, T V = 398,8 K, molarna masa, M = 8, g mol -, te arametr ojednh strukturnh grua: GRUPA T/K /atm v/(cm 3 mol - ) (=C ) AR 0,0 0, CH 3 0,00 0,7 55 -F 0,08 0,4 8 8 Oća razmatranja o zadatku Slčno kao kod 6 zadataka, za rocjenu eksermentalno teže dostunh svojstava organskh tvar često se rmjenjuje načelo strukturno-grunh dornosa Makroskosko svojstvo tvar rocjenjuje se na osnov dornosa tabelranh za ojedne strukturne grue koje tvore molekulu te tvar Lydersenov ostuak rmjer je jedne takve metode za rocjenu krtčnh arametara (LYDERSEN, 955) Eksermentaln odac za krtčne arametre dostun su u kemjskonženjerskm rručncma out (POLING, 976) 8 Oća razmatranja o zadatku Emrjske formule Lydersenova ostuka su: T T 0,567 T T v K M K 0,34, (8), (8) vk 40 v (83) Strukturna formula molekule entafluorotoluena je: CH 3 F C C C F F C C C F F Molekula se sastoj od šest aromatskh C-grua u rstenu, et fluordnh grua te jedne alfatske CH 3 -grue Sve dornose, dakle, treba zbrajat rema: 6 C 5 F CH AR Za temeraturn dornos dobje se: 3
116 T 60,050,08 0,00, T 0,76 Za tlak je: 60,54 50,4 0,7,,7 Za volumen se dobje: v , v 36 Krtčn arametr su: 390, 65 T 0,567 0,76 0,76 K 549 K, 8, 6,7 atm, K 0,34, vk cm mol 83 Komentar rješenja Da b se korelacja na osnov strukturno-grunh dornosa mogla rmjent, treba oznavat načelo odjele molekula u strukturne grue, koje se najčešće rkazuje u oblku tablce Za Lydersenovu metodu to je tablca Također, treba obratt ozornost na jednce; emrjske korelacje vrjede samo ako se uvrst brojčana vrjednost u točno određenm jedncama Lteraturn odac (POLING, 976) o krtčnm arametrma entafluorotoluena također su rocjenjene, a ne eksermentalne vrjednost, znose su: T 566,5 K, K K 3, 4 bar 30,83 atm, 3 - vk 384,00 cm mol Razlke u lteraturnm ovdje zračunatm vrjednostma su 3, % za krtčnu temeraturu, 3,4 % za krtčn tlak te 4,4 % za krtčn volumen
117 Strukturna grua Tablca 83 Tablca Lydersenovh strukturno-grunh arametara T/K /atm v/(cm 3 mol - ) Strukturna grua T/K /atm v/(cm 3 mol - ) -CH 3, -CH - 0,00 0,7 55,0 >CH 0,0 0,0 5,0 -C< - 0,0 4,0 =CH, CH 0,08 0,98 45,0 =C<,=C= - 0,98 36,0 =C-H, C- 0,005 0,53 36,0 -CH - (rsten) >C< (rsten) 0,03 0,84 44,5-0,007 0,54 3,0 >CH- (rsten) =CH-, =C<, =C= (rsten) 0,0 0,9 46,0 0,0 0,54 37,0 -F 0,08 0,4 8,0 -Cl 0,07 0,30 49,0 -Br 0,00 0,500 70,0 -I 0,0 0,830 95,0 -OH 0,08 0,060 8,0 -OH(aromatsk) 0,03-0,00 3,0 -O- 0,0 0,60 0,0 -O-(rsten) 0,04 0,0 8,0 >C=O 0,040 0,90 60,0 >C=O(rsten) 0,033 0,00 50,0 HC=O- 0,048 0,330 73,0 -COOH 0,085 0,400 80,0 -COO- 0,047 0,470 80,0 -NH 0,03 0,095 8,0 >NH 0,03 0,35 37,0 >NH(rsten) 0,04 0,090 7,0 >N 0,04 0,70 4,0 >N-(rsten) 0,007 0,30 3,0 -CN 0,060 0,360 80,0 -NO 0,055 0,40 78,0 -SH, -S- 0,05 0,70 55,0 -S-(rsten) 0,008 0,40 45,0 =S 0,003 0,40 47,0 >S< 0,030 0, B< 0, Lteratura Izvor: Robert C Red, John M Prausntz, Thomas K Sherwood, The Proertes of Gases and Lquds, 3 zd, Mc Graw Hll, New York, 977 str 8 Posebna lteratura: (LYDERSEN, 955) Aksel L Lydersen, Estmaton of Crtcal Proertes of Organc Comounds, Unversty of Wsconsn College Engneerng, Eng Ex Stn Re 3, Madson, Wsconsn, travanj 955 (POLING, 000) Bruce E Polng, John M Prausntz, John P O'Connell, The Proertes of Gases and Lquds, McGraw-Hll, New York, 000 3
118 9 Krtčna gustoća Calletet Mathas Procjent krtčnu gustoću roana rema Calletet-Mathasovom ravlu Termodnamčk odac su krtčna temeratura roana, T K = 96,8 C, te gustoće ravnotežne are, ρ L, odnosno kaljevne, ρ V, rema tablc: T/ C ρ L /(g cm -3 ) ρ V /(g cm -3 ) 30 0,4858 0, ,3760 0,083 9 Oća razmatranja o zadatku Calletet-Mathasovo ravlo nazva se još ravlo lnearnog djametra Rad se o emrjskom ravlu zasnovanom na eksermentalnm mjerenjma Lousa Paula Calleteta (z 870-h) te Émlea Ovdea Joseha Mathasa (z rvog desetljeća 0 stoljeća) Prema tom ravlu, olovca zbroja gustoća blo koje tvar u kaljevtom stanju stanju zasćene are na stoj temeratur je lnearna funkcja temerature Pravlo je lustrrano slkom 9 0,50-3 ρ/(g cm ) 0,4 CH 3 8 0,34 0,6 0,8 0,0 0, T/ C Slka 9 ovsnost gustoće zasćene are, odnosno kaljevne roana o temeratur O ovjesnom razvoju ravla lnearnog djametra sao je Smón Ref-Acherman (REIF- ACHERMAN, 00) Jednadžba Callethet-Mathasovog ravla glas: L V ρ + ρ ( T) = ρ = ρ + ct (9) 0 9 Rješenje zadatka Izraz (9) je jednadžba ravca, s odsječkom ρ 0 nagbom c Jednadžbu ravca defnraju dvje točke z teksta zadatka Za temeraturu od 30 C vrjed: 4
119 L V ρ + ρ 0, , = = = 0,59 g cm ρ Slčno je za temeraturu od 80 C: L V ρ + ρ 0, , = = = 0,96 g cm ρ Dvje jednadžbe s dvje neoznance: ρ T = ρ + ct, ( ) 0 0, 59 = ρ + c 30, 0, 96 = ρ + c 80, 0 0 omogućuju određvanje odsječka nagba ravca Izražavanjem odsječka z obje jednadžbe dobva se: 0, 59 30c = ρ 0, 0, 96 80c = ρ 0, odnosno: 0, 59 30c= 0, 96 80c, 50c = 0, 033 Nagb je odatle: c 4 3 = 4,66 0 g cm C Odsječak je zatm: 4 ( ) ρ 0 = 0, , 66 0, ρ 0 0,669 g cm 3 = Buduć da Calletet-Mathasov ravac rolaz kroz krtčnu točku, dobva se: ρ ( T ) = ρ + ct, K 0 K 4 ( ) ρ T K = 0, 669 4, ,8, ρ 3 ( T K ) 0,8 g cm = 93 Komentar rješenja Secfčn krtčn volumen je: v s,k 3 - ( T ) = ρ = 4,5cm g, K a krtčn molarn volumen je: 3 ( ) vk = M ρ TK = 44,096 0,8 = 98,8 cm mol, 5
120 što u usoredb s tabelranom vrjednošću krtčnog secfčnog volumena (KYUSHU, 03): v s,k 4,5455 cm g 3 =, odnosno eksermentalnog molarnog volumena (AMBROSE, 995): v K 00 cm mol 3 =, daje ocjenu točnost metode 94 Lteratura Izvor: Mhal Kh Karaetyants, Chemcal Thermodynamcs, Mr Publshers, Moskva, 978, str 7 Posebna lteratura: (AMBROSE, 995) Douglas Ambrose, Constantne Tsonooulos, Vaor-Lqud Crtcal Proertes of Elements and Comounds Normal Alkenes, Journal of Chemcal and Engneerng Data 40 (995) (KYUSHU, 03) htt://wwwcckyushu-uacj/sc/system/lbrary/propath/manuals/-roath/c3h8df, rstu 8 ožujka 03 (REIF-ACHERMAN, 00) Smón Ref-Acherman, The Hstory of the Rectlnear Dameter Law, Qumca Nova 33 (00)
121 0 Krtčn tlak Kreglewsk Kay Procjent krtčn tlak smjese etana() benzena() sastava y = 0,39 ostukom o Kreglewskom Kayu Eksermentalno određen krtčn arametr smjese znose: KM = 83,8 atm; T KM = 499, K Potrebn termodnamčk odac su: T K /K K /atm v K /cm 3 mol - v * /cm 3 mol - ω etan() 305,4 48, 48 54,87 0,098 benzen() 56, 48, ,97 0, 0 Oća razmatranja o zadatku Kreglewsk Kay (KREGLEWSKI, 969) su redložl ostuak kojm se na osnov razmjerno malog broja dostunh odataka o čstm tvarma mogu rocjent krtčn arametr (krtčn tlak, KM, krtčna temeratura, T KM ) dvokomonentnh smjesa Ovdje treba naomenut da se ne rad o jednostavnom ostuku Name, to nsu seudokrtčn arametr, ako se često korste st smbol Pseudokrtčn arametr (T KM KM ) služe za redukcju temerature, odnosno tlaka kod lnskh smjesa, računaju se najčešće jednostavnm ravlma out onh Prausntza Gunna (PRAUSNITZ, 958) nalaze se uobčajeno zmeđu vrjednost arametara komonenata S druge strane, krtčn arametr smjesa su rave eksermentalne vrjednost; r tm vrjednostma tlaka temerature kaljevta arna faza dvokomonentnog sustava maju dentčna svojstva (sastav gustoću) Krtčn arametr smjesa defnraju realno ostvarvu eksermentalnu točku, a seudokrtčn arametr defnraju točku koja se u većn slučajeva nalaz u dvofaznom, nestablnom odručju ne može se eksermentalno ostć, vd slku 0 K L K L+V PK K V Slka 0 -T djagram dvokomonentnog sustava u krtčnom odručju Za čste tvar rad se o krvuljama saravanja koje završavaju u krtčnm točkama komonenata, K, odnosno K Za smjese rad se o zatvorenoj etlj; krvulja ravnotežne kaljevne (una crta) ravnotežne are (srekdana crta) sastaju se u krtčnoj točk K; unutar etlje je nestablno odručje Krtčna lnja (točkasta crta) ovezuje krtčne točke smjesa razlčth sastava Pseudokrtčna lnja (crta-točka) ovezuje seudokrtčne točke smjesa razlčth sastava najčešće ne odstua znatno od ravca Shematsk je naznačena razlka seudokrtčne (PK) krtčne točke (K) smjese T 7
122 Podac koje Kreglewsk Kay korste za rocjenu krtčnh svojstava smjesa su: krtčne temerature komonenata, T K, krtčn tlakov komonenata, K, krtčn molarn volumen komonenata, v K, molarn volumen kaljevth komonenata, v *, mjeren r reducranoj temeratur od T r = 0,6 (retostavlja se da r toj temeratur molarn volumen kaljevne ne ovs znatno o tlaku) te Ptzerov koefcjent acentrčnost, ω Postuak razvjaju na osnov teorje tzv konformalnh otona 0 Rješenje zadatka Osnovn zraz za rocjenu krtčnog tlaka smjese glas: T = + ( 5, ,93ω ) T (0) * KM KM M * ω M je Ptzerov koefcjent acentrčnost smjese, a * T * su arametr redukcje tlaka, odnosno temerature Postuak zaočnje zračunavanjem srednjeg molarnog volumena kaljevte smjese, rema ravlu mješanja: ( ) v = yv + y v + v v v y y (0) * * * * * * M U zrazu se ojavljuje ukršten volumn arametar, kojega treba rvo zračunat osrednjvanjem lnearne dmenzje, rema: * * ( v) + ( v) * v = (03) 8 Uvrštavanjem se dobje: ( 54,87) + ( 93,97) * 3 7,7 cm mol v = =, 8 a zatm : ( ) ( ) ( ) * v = + +, M 0,39 54,87 0,39 93,97 7,7 54,87 93,97 0,39 0,39 * 3 v M = 77,8 cm mol U zrazma za zračunavanje krtčne temerature, kao koncentracjska varjabla ojavljuje se ovršnsk udo Računa se rema: θ = 3 * y( v) * * ( ) + ( ) 3 3 y v y v Nakon uvrštavanja sljed: (04) 3 0,39( 54,87) ( ) + ( )( ) θ = = 0,3; 3 3 0,39 54,87 0,39 93,97 θ = θ = 0, 689 8
123 Pravlo mješanja za arametar redukcje temerature glas: T * 3 * * K K K K = M + + θ θ ( v ) T θ T θ T T T * * * * * ( v) ( v ) ( v) ( v) ( v) Ukršten temeraturn arametar računa se rema: T = 3 * ( v ) * * ( ) + ( ) * 3 3 v TK v TK Nakon uvrštavanja dobva se: 3 7,7 ( ) ( ) + ( ) * T = = 406, 58 K, ,87 305, 4 93,97 56, T * (05) (06) 3 305, 4 0,3 56, 0, ,58 305, 4 56, = ( 77,8) + + 0,3 0, , ( 54,87) ( 93,97) ( 7, 7) ( 54,87) ( 93,97) * T = 46,084 K Krtčna temeratura računa se rema: T = ϕ T + ϕ T, (07) KM K K gdje je ϕ koncentracjska varjabla, krtčn volumn udo: yv K ϕ = y v + y v K K (08) Nakon uvrštavanja dobva se: 0,39 48 ϕ = = 0,69, 0, ,39 59 ϕ = ϕ = 0, 73, ( ) T KM = 0,69 305,4 + 0,73 56, = 49,988 K Parametar redukcje tlaka zračunava se rema: T θ + * * K K = * * * ( vm) ( TKθ) ( v) + ( TKθ) ( v) Uvrštavanjem se dobva: * θ ( 77,8) 305, 4 0,3 ( 54,87) + 56, 0, 689 ( 93,97) (09) 46,084 48, 0,3+ 48,3 0, 689 = = 47,38 9
124 Ptzerov koefcjent acentrčnost za smjesu zračunava se rema sljedećem ravlu mješanja: ( ) ω = ωθ + ωθ + ω ω ω θθ, (00) M Gdje je ukršten arametar koefcjenta acentrčnost: ω = (0) ω + ω Nakon uvrštavanja dobva se: ω = 0, ,098+ 0, =, ( ) ω M = 0,098 0,3+ 0, 0, , ,098 0, 0,3 0,689 = 0,676 Krtčn se tlak smjese sada zračunava na osnov zraza (0): T = + ( 5, ,93ω ) T, * KM KM M * KM KM 49,988 = 47,38 + ( 5, ,93 0,676) 46,084, = 68,40 atm 03 Komentar rješenja Na slc 0 rkazane su seudokrtčna krtčna krvulja smjese (krtčn koefcjent komresblnost su z K = 0,79, z K = 0,68) u usoredb s eksermentalnm odacma (WAUQUIE, 000) Unatoč složenom ostuku rocjene, odstuanja su još uvjek znatna eksermentalna vrjednost krtčnog tlaka znos 83,8 atm 0 /atm etan() benzen() T/K Slka 0 Izvadak -T djagrama dvokomonentnog sustava Plavom je bojom rkazana krtčna, a crvenom seudokrtčna krvulja Crnom su bojom označen eksermentaln odac (WAUQUIE, 000) 0
125 04 Lteratura Izvor: Robert C Red, John M Prausntz, Thomas K Sherwood, The Proertes of Gases and Lquds, 3 zd, Mc Graw Hll, New York, 977 str 46 Posebna lteratura: (KREGLEWSKI, 969) Aleksander Kreglewsk, Webster B Kay, The Crtcal Constants of Conformal Mxtures, The Journal of Physcal Chemstry 73 (969) (PRAUSNITZ, 958) John M Prausntz, R D Gunn, Volumetrc Proertes of Nonolar Gaseous Mxtures, Amercan Insttute of Chemcal Engneers Journal 4 (958) (WAUQUIER, 000) Jean-Perre Wauquer, Petroleum Refnng, Vol Searaton Processes, Edtons Techn, Parz, 000 str 5, rjevod rema orgnalu: Le raffnage du étrole Tome Procédés de séaraton, Edtons Techn, Parz, 998
126 Equaton Secton Pseudokrtčn arametr Izračunat seudokrtčne arametre ekvmolarne smjese etana(), roana() butana(3) rema A) Prausntz-Gunnovm ravlma, B) Redlch-Kwongovm ravlma Potrebn termodnamčk odac su: T K /K K /bar v K /cm 3 mol - z K etan() 305,4 48,8 48,3 0,85 0,099 roan() 369,8 4,5 03 0,8 0,53 butan(3) 46, ,74 0,99 Oća razmatranja o zadatku Pseudokrtčn arametr su velčne koje služe za reducranje tlaka, odnosno temerature kod smjesa fluda Ne rad se o krtčnom tlaku, odnosno temeratur smjese, ako se često korst st smbol za obje velčne, KM, odnosno T KM Razlku th velčna najbolje je objasnt slkom, nr 0 Kayeva Prausntz-Gunnova ravla Kayeva ravla (KAY, 936) za zračunavanje seudokrtčnog tlaka, KM, odnosno temerature, T KM, na osnov svojstava krtčnog tlaka, K, temerature, T K, za komonente lnskh smjesa glase: T KM yt, () K KM y () K Ovdje se može rdodat ravlo za seudokrtčn molarn volumen: v KM yv (3) K Točnj je Prausntz-Gunnov sku ravla (PRAUSNITZ, 958) Jednostavna formulacja ravla jest: T KM KM yt, (4) K yzk yv M RT K KM (5) y (6) M ovdje označavaju Ptzerov koefcjent acentrčnost za smjesu, odnosno komonentu 3 Rješenje zadatka A) Zadana je smjesa:
127 etan() roan() butan(3) Rad se o ekvmolarnoj smjes, dakle molarn udjel trju komonenata jednak su: y 3 Kayevo ravlo za zračunavanje seudokrtčne temerature reuzel su Prausntz Gunn: T KM yt K Prausntz-Gunnovo ravlo za seudokrtčn tlak, jednadžba (4) nasat će se na sljedeć načn: z RT KM KM KM (7) vkm Pseudokrtčn molarn volumen jest: v v KM yv, K 3 KM 348, ,89 cm mol Pseudokrtčn koefcjent komresblnost je: z KM KM y z, K z 3 0,85 3 0,8 3 0,74 0,797 Pseudokrtčna temeratura je, rema (3): T 3 305, ,8 3 46, 366,4 K KM Pseudokrtčn tlak je: 0,7978,34366,4 KM 40,8 kpa 6 0,890 Ptzerov koefcjent acentrčnost smjese rocjenjuje se rema: 3 0, ,53 3 0,99 0,50 M 4 Redlch-Kwongova ravla Godne 949 Redlch Kwong (REDLICH, 949) objavl su jednadžbu stanja trećeg stunja rkladnu za stodobnu rocjenu ravnotežnh molarnh volumena are kaljevne z ogrančenog skua termodnamčkh odataka, name z krtčne temerature tlaka fluda Jednadžba ovezuje tlak,, temeraturu, T, molarn volumen, v: RT a v b Tv v b (8) Rad se o olnomnoj jednadžb trećega stunja o volumenu: 3 RT RTb a ab v v b v T T 0, (9) odnosno koefcjentu komresblnost z: 3
128 b b a ab 0 (0) RT RT RT T RT T 3 z z z 3 3 Parametr jednadžbe stanja a b zračunavaju se z krtčnh arametara, tlaka, K, odnosno temerature, T K, rema: 5 R T a K a, () b K RT b K () K Jednadžba stanja Redlcha Kwonga može se rkazat u oblku koj odgovara rmjen načela koresondentnh stanja Reducran molarn volumen te koefcjent komresblnost funkcja su samo reducrane temerature reducranog tlaka, rema: r vr 3Tr, (3) Tv r r vr odnosno: 3 r r r r z z 0 5 z, (4) 7 9Tr 3Tr 9 Tr 7Tr gdje je: 3 (5) Da b se zraz ( 5) rmjenl na lnsku smjesu, otrebno je defnrat arametre redukcje za tlak, temeraturu, odnosno molarn volumen To su tzv seudokrtčn arametr Izračunavaju se rema zrazma (nr AUNGIER, 995): T v KM KM T y TKM T y T 5/ K T y K K K K K /3, (6), (7) y v KM K K KM KM T (8) K 5 Rješenje zadatka B) Zadana je smjesa: etan() roan() butan(3) Kod ekvmolarne smjese molarn udjel trju komonenata jednak su: 4
129 y 3 Prvo se zračunava seudokrtčna temeratura Uvrštavanjem u (6) dobva se: T KM 5/ 5/ 5/ 305, 4 369,8 46, 0,33 0,33 0, ,80 4,50 38, , 4 369,8 46, 0,33 0,33 0, ,80 4,50 38,0 0 /3, 0,96 0, 6 0,33 TKM 5 5 5,0860,9000 3,7390 Pseudokrtčn tlak je, z (7): 366,,0860,9000 3,7390 KM ,3 kpa KM /3 366 K Pseudokrtčn molarn volumen znos, rema (7): v ,3348,8 0 48,30 0,334, ,3338, , 4, , 4 369,8 46, KM 5 v KM 3 00,733cm mol 6 Lteratura Izvor: Robert C Red, John M Prausntz, Thomas K Sherwood, The Proertes of Gases and Lquds, 3 zd, Mc Graw Hll, New York, 977 str 74 Posebna lteratura: (AUNGIER, 995) Ronald H Aunger, A Fast, Accurate Real Gas Equaton of State for Flud Dynamc Analyss Alcatons, Journal of Fluds Engneerng 7 (995) 77 8 (KAY, 936) W B Kay, Densty of Hydrocarbon Gases and Vaors at Hgh Pressure and Temerature, Industral and Engneerng Chemstry Research, 8 (936) (PRAUSNITZ, 958) John M Prausntz, R D Gunn, Volumetrc Proertes of Nonolar Gaseous Mxtures, Amercan Insttute of Chemcal Engneers Journal 4 (958) (REDLICH, 949) Otto Redlch, Joseh NS Kwong, On The Thermodynamcs of Solutons, Chemcal Revews 44 (949)
130 Equaton Secton Funkcje odstuanja Lee Kessler Izračunat secfčne funkcje odstuanja entalje entroje rema Lee-Keslerovom ostuku za roen r 5 C 0 MPa, uz referentn tlak od bar Potrebn termodnamčk odac su: T K = 365 K; K = 45,6 atm; = 0,48, M = 4,08 g mol - Funkcje odstuanja Funkcje odstuanja (engl dearture functon l devaton functon) su zvedene termodnamčke velčne; funkcja odstuanja za neku termodnamčku velčnu jest razlka velčne realnoga fluda r zadanom tlaku temeratur velčne dealnog fluda r stoj toj temeratur referentnom tlaku Funkcje odstuanja omogućavaju jednostavno zračunavanje znosa entalje, entroje, unutrašnje energje realnog fluda u ovsnost o tlaku, uzmaju u obzr nedealnost fluda skazanu jednadžbom stanja Načelno, mogu se zračunat na osnov blo koje jednadžbe stanja Izračunavanje funkcja odstuanja Iznos velčne stanja realnoga fluda u načelu se teško (entroja) l nkako (entalja, unutrašnja energja ) ne može odredt u asolutnom znosu Određuje se, međutm, znos u odnosu na odabrano referentno stanje Neka je y ref znos molarne velčne stanja dealnog lna r referentnom tlaku referentnoj temeratur T Iznos ste velčne stanja realnog fluda r zadanom tlaku temeratur tada se može zračunat kao: d d real T y y y y yref dt d d T () T 0 Drug član na desnoj stran osuje ovsnost molarne velčne stanja dealnog lna o temeratur zračunava se z temeraturne ovsnost tolnskog kaacteta dealnog lna, c d (T) Treć četvrt član zajedno tvore funkcju odstuanja Za entalju entroju, zraz () može se sat kao: T d v h href c T dt 0 v T d, () T T 0 odnosno, T d c R v s sref dt Rln d T (3) T T 0 Odgovarajuće funkcje odstuanja su, rema tome: v hh vt d, (4) T 0 6
131 R v ss Rln d (5) T 0 Prkazan zraz za funkcje odstuanja odražavaju čnjencu da entalja dealnog lna, za razlku od entroje, ne ovs o tlaku Također, z zraza je jasno da se funkcje odstuanja mogu zračunat z jednadžb stanja, tj uz oznavanje ovsnost, v = f(,t) U kemjskom su nženjerstvu znatno češće jednadžbe stanja ekslctne o tlaku Pokazuje se da su kod takvh jednadžb rkladnj sljedeć zraz za funkcje odstuanja: v hh RTz T dv, (6) T v v v R ss Rln dv v (7) T v v 3 Lee-Keslerov ostuak Prema načelu termodnamčke slčnost, u jednoj njegovoj načc, dva fluda stog Ptzerova koefcjenta acentrčnost,, r stm uvjetma reducranog tlaka reducrane temerature r, odnosno T r, mat će st znos reducranog molarnog volumena, v r, odnosno st koefcjent komresblnost, z To se najlakše formulra na sljedeć načn: r r r v f, T,, (8) r r z f, T, (9) Može se okazat da se funkcje odstuanja vladaju rema načelu termodnamčke slčnost Vrjed name: r hh z RTr T K 0 r T r r r z T r z ss R dr 0 r r Tr r Stoga vrjed: h h T K f r r dr ; (0) (), T,, () r r ss f, T, (3) Praktčnu rmjenu rethodnh dvju jednadžb u kemjskom nženjerstvu ostvarl su Lee Kesler (LEE, 975) Prmjena načela termodnamčke slčnost (na koefcjent komresblnost z) u oblku Lee-Keslerove korelacje lustrrana je slkom 7 jednadžbama u odjeljku 7 Ovdje se daju samo krajnj zraz za funkcje odstuanja entalje, odnosno entroje: (0) () h h h h h h RT RT RT T, T, r r r r K K K, (4) 7
132 (0) () s s s s r, r s s T Tr, rln (5) R R R Članov označen s (0) odnose se na flud sferčnh čestca argon, = 0,00, 0, a članov označen s () odnose se na odstuanje usljed nesferčnost zračunat su na osnov razlke znosa funkcja odstuanja n-oktana kao referentnog lna zduljenh čestca znatno većeg koefcjenta acentrčnost, = 0,399, oznaka (R), argona: () (R) (0) h h h h h h (R), (6) RTK RTK RT K () (R) (0) s s ss ss (R) (7) R R R Vrjednost (h h)/(rt K ) (s s)/r označene s (0) () Lee Kesler su zračunal kao funkcje reducranog tlaka temerature objavl h u tablčnom oblku Izračunavanje je rovedeno na osnov Starlngove modfkacje Benedct-Webb-Rubnove (BWR) jednadžbe stanja (STARLING, 973), na osnov lteraturnh vrjednost arametara za argon n-oktan 4 Rješenje zadatka Zadana je temeratura: T 5 C, tlak: 0 MPa, roena Zadatkom treba zračunat funkcje odstuanja entalje, odnosno entroje, u odnosu na referentn tlak od: bar Prvo se zračunavaju vrjednost reducrane temerature tlaka: T 398,5 T,09,,0 r TK 365, ,00 r,64,00 K 45,6 035 Vrjednost se nalaze zmeđu tabelranh, a je otrebno rovest dvostruku lnearnu nterolacju, rema formul: y y y y xx x x Rezultat su, za funkcju [(h h)/(rt K ) (0) ], slka : 8
133 h h RTK h h RTK h h RTK h h RTK h h RTK h h RTK T, 053,398,64, 00 T R R,05 3,48 3,5833,398 3,00,00 T,0,965,64, 00 T R R,0 3, 09 3,353,965 3,00,00 T,093,48,09,05 T R R, 09 3,0 3,09 3,48,0, 05,, Slka Očtavanje [(h h)/(rt K )] (0) za redmetne vrjednost r T r z Lee-Keslerovh tablca Za funkcju [(h h)/(rt K ) () ], slka : h h RTK h h RTK T, 05,38,64, 00 T R R,05,450,800,38 3,00,00, 9
134 h h RTK h h RTK h h RTK h h RTK T,0, 6,64, 00 T R R,0, 40,67, 6 3,00,00 T,09,450,09,05 T R R, 09,597,40,450,0, 05, Slka Očtavanje [(h h)/(rt K )] () za redmetne vrjednost r T r z Lee-Keslerovh tablca Za funkcju [(s s)/r (0) ], slka 3: s s R s s R s s R s s R T, 05, 483,64, 00 T R R,05,47,45,483 3,00,00 T,0, 08,64, 00 T R R,0,00,0,08 3,00,00,, 30
135 3 0 R 0 R,00, 47,09,47,09,05,0, 05, 09,67 s s T R s s T R Slka 3 Očtavanje [(s s)/r)] (0) za redmetne vrjednost r T r z Lee-Keslerovh tablca Za funkcju [(s s)/r () ], slka 4: R R,655,83, 05, 83,64, 00 3,00,00, 05,344 s s T R s s T R, R R,067,4,0, 4,64, 00 3,00,00,0,376 s s T R s s T R, R R,376,344, 09,344, 09, 05,0, 05, 09,550 s s T R s s T R
136 Slka 4 Očtavanje [(s s)/r)] () za redmetne vrjednost r T r z Lee-Keslerovh tablca Iznos molarne funkcje odstuanja entalje tada se zračunava rema: h h h h h h RTK RTK RT K (0) (), a secfčna funkcja odstuanja entalje je: h (0) () RT K h h h h h s M RTK RTK Nakon uvrštavanja dobva se: h h 8, ,0 0,48,597 40,669 J g s 4,08 Molarna funkcja odstuanja entroje je: (0) () s s r, r s s s R T s Tr, r ln, R R a secfčna: R (0) () s s, s s, ln s M R R s s Tr r Tr r Nakon uvrštavanja dobva se: 3
137 5 8,34 0 s s,67 0,48,550 ln,3833 J g K s 7 4,08 0 Ovdje treba obratt ozornost na redznak rješenja Name, u klasčnoj formulacj, funkcje odstuanja defnraju se kao h h, odnosno s s Stoga treba sat: hh 40,669 J g s ss,3833 J g K s, 5 Komentar rješenja Dobven znos funkcje odstuanja najčešće se rmjenjuje za zračunavanje entaljskh, odnosno entrojskh romjena r razlčtm rocesma Kod zotermnh rocesa, vrjed jednostavan zraz, na rmjeru entalje: h h h h h h T, T, T Kod rocesa koj uključuju romjenu temerature, treba uzet u obzr ovsnost termodnamčke velčne o temeratur Na rmjeru entalje, dobva se: T d,, T h T h T c T dt h h h h T,, T 6 Lteratura Izvor: Robert C Red, John M Prausntz, Thomas K Sherwood, The Proertes of Gases and Lquds, 3 zd, Mc Graw Hll, New York, 977 str 4 Posebna lteratura: (LEE, 975) Byung Ik Lee, Mchael G Kesler, A Generalzed Thermodynamc Correlaton Based on Three- Parameter Corresondng States, Amercan Insttute of Chemcal Engneers Journal (975) (STARLING, 973) Kenneth E Starlng, Flud Thermodynamc Proertes for Lght Petroleum Systems, Gulf Publshng Co, Houston,
138 Equaton Secton 33 Parcjaln molarn volumen grafčko dferencranje Pknometrjskom su metodom određene gustoće otona etanola() vode() u cjelom odručju sastava Treba odredt arcjaln molarn volumen etanola za otonu sastava w = 0,40 metodom grafčkog dferencranja dervranja Molarne mase komonenata su M = 46,07 g mol - ; M = 8,0 g mol - Eksermentaln odac su: w /% 0,05 0,03 30,0 39,99 50,0 59,99 70,0 80,03 /(g cm -3 ) 0,988 0,9686 0,9538 0,935 0,938 0,89 0,8676 0, Rješenje zadatka Postuak grafčkog dervranja dferencranja, vd nr (KLOTZ, 008), u er suvremenh računala je donekle zastaro Iak, ovdje se rkazuje kao zanmljvost, na rmjeru određvanja arcjalnh molarnh volumena Postuak se zasnva na rmjen defncjske jednadžbe arcjalnog molarnog volumena: V v, (3) n T,, n a najlakše ga je lustrrat uravo rmjenom Sastoj se od deset koraka Postavljanje baze roračuna U ovom se slučaju kao baza roračuna odabre fksna masa, nr 00 g otone Izračunavanje kolčna komonenata Kolčne (množne) komonenata zračunavaju se na osnov eksermentalnh odataka Za rvu eksermentalnu točku tako vrjed: n n mw 000,005 0,8 mol, M 46,07 m w 000,005 4,99 mol M 8,0 Podac za sve točke rkazan su u tablc: n /mol 0,8 0,435 0,65 0,868,086,30,50,737 n /mol 4,99 4,438 3,884 3,330,774,0,664,08 3 Normalzranje kolčna komonenata Kao osnova za normalzranje uzma se mol komonente Iz razmjera: n n, mol n 34
139 sljed, za rvu eksermentalnu točku: n n 0,8 mol 0,044 mol n 4,99 Podac za sve točke rkazan su u tablc: n' /mol 0,044 0,098 0,68 0,6 0,39 0,585 0,93,567 4 Normalzranje mase otone Izračunava se ukuna masa otone koja sadržava mol vode Za rvu eksermentalnu točku dobva se: mnm molm 0,04446,07 8,0 0,05g Podac za sve točke su: m'/g 0,05,53 5,76 30,04 36,08 44,97 60,08 90, 5 Normalzranje volumena otone Izračunava se ukun volumen otone koja sadržava mol vode Za rvu eksermentalnu točku dobva se: m 0,05 V 0,989 Podac za sve točke su: 3 0,4 cm V'/cm 3 0,4 3,6 7,0 3, 39,48 50,46 69,5 06,96 Podac V' = f(n' ) omogućuju rmjenu metode tangente za određvanje arcjalnog molarnog volumena komonente Na slc 3 rkazana je ovsnost normalzranog volumena o normalzranoj kolčn komonente 00 V /cm ,5,0,5 n /mol Slka 3 Normalzran volumen otone (volumen otone koja sadržava mol komonente, V') kao funkcja normalzrane kolčne komonente (kolčna komonente u oton koja sadržava mol komonente, n ') 35
140 Prmjena metode tangente zravno daje arcjaln molarn volumen komonente rema defncjskoj jedandžb (3) kao nagb krvulje za defnran sastav otone, skazan kolčnom komonente o molu komonente! Slka 3, međutm, okazuje da je rmjena metode tangente u rkazanom slučaju osve neraktčna, jer kod malh romjena volumena r mješanju, ovsnost V' = f(n' ) ne odstua znatno od ravca, a je nemoguće reczno očtat male romjene nagba 6 Izračunavanje rrasta kolčne Grafčko dferencranje dervranje zahtjeva zračunavanje rrasta kolčne komonente zmeđu dvju susjednh eksermentalnh točk Na rmjeru rve dvje točke dobva se: n n n 0,098 0,044 0,054 mol, a za sve točke dobva se: = = =3 =4 =5 =6 =7 =8 n' /mol 0,054 0,070 0,093 0,3 0,93 0,38 0,654 7 Izračunavanje rrasta volumena Grafčko dferencranje dervranje zahtjeva zračunavanje rrasta ukunog volumena zmeđu dvju susjednh eksermentalnh točk Za rve dvje točke dobva se: 3 3,6 0,4,84 cm V V V Za sve točke odac su rkazan tablčno: = = =3 =4 =5 =6 =7 =8 V'/cm 3,840 3,750 5,0 7,360 0,98 8,79 37,7 8 Izračunavanje omjera rrasta Prred se omjer dvaju rrasta; za rve dvje točke: V,84 =5,59 cm mol n 0,054 3, te za sve točke tablčno: = = =3 =4 =5 =6 =7 =8 V n /(cm3 mol - ) 5,59 53,57 54,95 56,8 56,89 57,9 57,66 9 Grafčk rkaz Prred se graf (V'/n' ) = f(n' ) tako da se crta stalan rrast od jedne do druge eksermentalne točke (steenast djagram) Graf je rkazan na slc 3 36
141 -3 ( V / n )/(mol cm ) l -3 ( V / n )/(mol cm ) n /mol 0,5,0,5 Slka 3 Grafčk rkaz rrasta, odnosno dferencjala volumena o kolčn dodane komonente uz stalnu kolčnu ( mol) komonente Iz grafčkog rkaza zravno se očtavaju vrjednost arcjalnh molarnh volumena rema defncjskom zrazu (3) 0 Očtavanje Za zadan masen udo: w 0, 40, zračuna se odgovarajuća vrjednost ascse: n w M 0,40 46,07 mol 0,6068 mol w M 0,40 8,0 S djagrama se zravno očta znos arcjalnog molarnog volumena komonente V v n 55,65 cm mol 3 3 Komentar rješenja Ovakav ostuak omogućuje određvanje arcjalnog molarnog volumena komonente Za određvanje arcjalnog molarnog volumena komonente, otrebno je zamjent ndekse komonenata, l ak rmjent Gbbs-Duhemovu jednadžbu 33 Lteratura Izvor: Ivca Štern, Fzkalna kemja, Prmjer z termodnamke, Tehnčka knjga, Zagreb, 968, str 53 Posebna lteratura: (KLOTZ, 008) Irvng M Klotz, Robert M Rosenberg, Chemcal Thermodynamcs: Basc Concets and Methods, 7 zd, Wley, New York,
142 Equaton Secton 44 Parcjaln molarn volumen metoda odsječka Pknometrjskom su metodom određene gustoće otona metanola() vode() u cjelom odručju sastava Treba odredt arcjaln molarn volumen obju komonenata za otonu sastava x = 0,40 metodom odsječka Molarne mase komonenata su M = 3 g mol - ; M = 8 g mol - Eksermentaln odac su: w /% /(g cm -3 ) 0,998 0,9666 0,9345 0,8946 0,8469 0,80 0,797 4 Metoda odsječka Metoda odsječka je grafčka ( numerčka) metoda omoću koje se u dvokomonentnm sustavma mogu odredt arcjalne molarne velčne Zasnva se na oćem zrazu koj ovezuje molarnu velčnu smjese y s odgovarajućm arcjalnm molarnm velčnama: y xy xy (4) Izraz koj ovezuje molarne udjele komonenata je: x x, (4) a se može sat: y y x y y (43) Rad se o jednadžb ravca u y-x -djagramu Međutm, oćent zraz za određvanje arcjalne molarne velčne komonente na osnov oznate ovsnost molarne velčne o sastavu glas: y y x y x T, (44) Usorede l se rethodna dva zraza dobva se: y y y (45) x T, Nagb ravca y y određen je dakle tangentom na krvulju ovsnost molarne velčne o sastavu Tangenta na osma čsth komonenata odsjeca odgovarajuće znose arcjalnh molarnh velčna Metoda je lustrrana slkom 4 Metoda odsječka osana je za dvokomonentne otone, al je sasvm oćenta može se rošrt na všekomonentne otone U tom se slučaju tangentn ravac zamjenjuje tangentnom ravnnom u 3D-djagramu l ak tangentnm herravnnama u všedmenzjskm rostorma Odsječak na osma čsth komonenata uvjek tvor arcjalnu molarnu velčnu (ROGOŠIĆ, 03) Za dvokomonentne sustave, kad je romatrana velčna volumen, može se sat: 38
143 v v vx x T, v v vx x T,, (46) (47) y y y y y y y ref 0 Slka 4 Metoda odsječka određvanje arcjalnh molarnh velčna z eksermentalne ovsnost molarne velčne o sastavu za dvokomonentnu otonu Velčne se skazuju relatvno, rema odabranoj referentnoj vrjednost y ref x 4 Rješenje zadatka Zadatak će se rješt u sedam, odnosno devet koraka Postavljanje baze roračuna U ovom se slučaju kao baza roračuna odabre fksna masa, nr 00 g otone Izračunavanje kolčna komonenata Kolčne (množne) komonenata zračunavaju se na osnov eksermentalnh odataka Za drugu eksermentalnu točku vrjed: n n mw 000,0 0,65 mol, M 3 m w 000, 0 4, 44 mol M 8 Podac za sve točke rkazan su u tablc: 39
144 n /mol 0 0,65,50,875,50,85 3,5 n /mol 5,555 4,444 3,333,, 0, Izračunavanje molarnh udjela Molarn udjel za komonente u drugoj eksermentalnoj točk su: x n 0,65 nn 0,65 4,444 x n 4,444 nn 0,65 4,444 0,3 mol, 0,877 mol Podac za sve točke rkazan su u tablc: x 0 0,33 0,77 0,4577 0,693 0,835 x 0,8767 0,773 0,543 0,3077 0, Izračunavanje srednje molarne mase Srednja molarna masa za drugu eksermentalnu točku je: M xm xm 0, ,3 3 9, 74 g mol Podac za sve točke su: M/(g mol - ) 8 9,7,8 4,4 7,69 9, Izračunavanje molarnog volumena Molarn volumen za drugu eksermentalnu točku je: v M 9,7 0,9666 0,40 cm mol 3 Podac za sve eksermentalne točke su: v/(cm 3 mol - ) 8,03 0,40 3,35 7,6 3,70 36,0 40,4 6 Grafčk rkaz molarnog volumena Podac v = f(x ) [l v = f(x )] omogućavaju rmjenu metode odsječka Podac su rkazan na slc 4 40
145 v/(cm mol ) , 0,4 0,6 0,8,0 x Slka 4 Molarn volumen kao funkcja sastava otone skazanog molarnm udjelom x Tangenta na krvulju ovsnost u točk željenog sastava na osma čsth komonent tvor odsječke arcjalne molarne volumene 7 Očtavanje arcjalnh molarnh volumena Odsječc su, rema slc: v 38 cm mol 3, v 8 cm mol 3 Očtavanje je, rema slc, razmjerno nereczno Stoga je bolje roračun rovest na drug načn 6a Izračunavanje volumena dealne otone eksces volumena Volumen dealne otone zračunava se, na rmjeru druge eksermentalne točke, rema: d 3 v xv xv0,3340,4 0,8767 8,03 0,7907 cm mol, a eksces volumen rema: ex v d vv 3 0, 40 0, , cm mol Podac za sve točke su: v d /(cm 3 mol - ) 8,03 0,79 4,4 8,8 33,53 36,73 40,4 v ex /(cm 3 mol - ) 0-0,3907-0,7858 -,079-0,8306-0, a Grafčk rkaz eksces volumena Eksces volumen rkazan je kao funkcja sastava otone, v ex = f(x ) na slc 43 4
146 x 0, 0,4 0,6 0,8 0-0, -0,4-0,6-0,8 -,0 ex 3 - v /(cm mol ) Slka 43 Eksces volumen kao funkcja sastava otone skazanog molarnm udjelom x Tangenta na krvulju ovsnost u točk željenog sastava na osma čsth komonent tvor odsječke arcjalne eksces molarne volumene 8 Očtavanje arcjalnh eksces molarnh volumena Odsječc su, rema slc: ex 3 v, 46 cm mol, ex 3 v 0,6 cm mol 9 Izračunavanje arcjalnh molarnh volumena Parcjaln molarn volumen za zadan sastav otone su: v v v 40,4,46 38,96cm mol ex 3, v v v 8,03 0,6 7,48 cm mol ex 3 43 Lteratura Izvor: Mhal Kh Karaetyants, Chemcal Thermodynamcs, Mr Publshers, Moskva, 978, str 63 Posebna lteratura: (ROGOŠIĆ, 03) Marko Rogošć, Kemjsko-nženjerska termodnamka (Nastavn tekstov), Fakultet kemjskog nženjerstva tehnologje Sveučlšta u Zagrebu (ntern tekst), Zagreb, 03 4
147 Equaton Secton 55 Parcjaln molarn volumen emrjska funkcja U jedan kg H O ostuno se, r stalnom tlaku temeratur, dodaje sol S mjer se romjena volumena otone Rezultat mjerenja rkazan su emrjskom ovsnošću o molaltetu, odnosno kolčn dodane sol, zrazma: V cm 00,38 6,653 m/ mol kg,7738 m/ mol kg 0,94 m/ mol kg, 3 3 cm 00,38 6,653 / mol,7738 / mol 0,94 / mol V n n n Treba odredt arcjaln molarn volumen obju komonenata za otonu molalteta m = 0,5 mol kg Potrebn odac još su: v = 8,08 cm 3 mol ; M = 8 g mol 5 Oća razmatranja o zadatku Prkazan su odac tčan odzv dobro dzajnranoga eksermenta U velku masu vode dodaje se sol u obrocma mjer se romjena volumena otone Mjerna osuda je velkog volumena, rma velku kolčnu otaala, vjerojatno je oremljena graduranom cjevčcom kojom se mogu s dovoljnom reczno mjert razmjerno male romjene volumena rlkom dodavanja sol Cjel je sustav još termostatran, jer gustoća kaljevna znatno ovs o temeratur, osebce stoga što otaanje sol uobčajeno rate određen tolnsk efekt Podac se mogu rkazat u oblku tablčne ovsnost volumena, V, o molaltetu, m, odnosno kolčn dodane sol, n Sv su odac reračunat na jednčnu masu vode, kg, a je molaltet brojčano jednak kolčn dodane sol 5 Gbbs-Duhemova jednadžba Gbbs-Duhemova jednadžba osuje međusobnu ovsnost arcjalnh molarnh velčna u sustavu Jednostavno ju je lustrrat omoću metode odsječka, slka 5 Oćent skaz Gbbs-Duhemove jednadžbe u všekomonentnm sustavma glas: ndy 0, (5) l: xdy 0 (5) Za dvokomonentne sustave, kad je romatrana velčna volumen, može se sat: ndv ndv 0 (53) Prkazana jednadžba, uz osnovn defncjsk zraz za arcjaln molarn volumen komonente : V v, (54) n n,, T osnova je rješavanja zadatka 43
148 y y y y x 0 Slka 5 Za defnranu, eksermentom otvrđenu krvulju ovsnost ekstenzvne velčne y o sastavu dvokomonentnog sustava skazanog molarnm udjelom jedne komonenata, x, tangenta na krvulju na osma čsth komonenata daje arcjalne molarne velčne S romjenom sastava, x, tangenta se valja o krvulj, mjenjaju se odsječc, a znos rrasta arcjalnh molarnh velčna y y su međuovsn Dok jedna arcjalna molarna velčna raste, druga mora adat! x 53 Rješenje zadatka Određvanje arcjalnog molarnog volumena otoljene sol Polaz se od defncjske jednadžbe za arcjaln molarn volumen (54): V v n n,, T Uvrštavanjem zraza z teksta zadatka dobva se: v 00,38 6, 653n, 7738n 0,94n 3 n te nakon dferencranja: 3 v 6, 653, 7738n 0,94n, v 6, 653, 6607n 0, 388n (55) Za bazu roračuna od kg vode, otona zadanog molalteta m = 0,5 mol kg n = 0,5 mol otoljene sol Parcjaln molarn volumen stoga je: v 6, 653, 66070,5 0, 388 0,5 ;, sadrž 44
149 v 8,66cm mol 3 Određvanje arcjalnog molarnog volumena otaala Iz Gbbs-Duhemove jednadžbe (53): ndv ndv 0, sljed: ndv ndv, dalje: n dv dv n Parcjaln molarn volumen otaala (vode) može se odredt ntegrranjem, rema: v n v n n dv dv vn 0 vn 0 n Grance ntegracje na ljevoj stran jednadžbe su: gornja (tražen) arcjaln molarn volumen otaala r željenom sastavu otone skazanom reko m, odnosno n, donja arcjaln molarn volumen otaala r n = 0 No, tu se zaravo rad o molarnom volumenu čstog otaala: v, koj je zadan zadatkom: v = 8,08 cm 3 mol Stoga se dobva: v n n vn 0 n v v dv, odnosno: v n n vn 0 n v v dv U rethodnom zrazu, na desnoj stran jednadžbe ojavljuje se konstanta; kolčna vode u rkazanom eksermentu je stalna: v n n vn0 v v n dv (56) Kolčna vode zračuna se z mase molarne mase: n m 55,56 mol M 0,08 Preostaje defnranje ntegrala na desnoj stran Izrazom (54) rkazana je ovsnost arcjalnog molarnog volumena otoljene sol o njenoj kolčn: v 6, 653, 6607n 0, 388n Dferencranjem jednadžbe o n dobva se: 45
150 v n v n 6, 653, 6607n 0, 388n n v n,6607 n 0,388,,33035n 0, 338, te zatm: dv,33035n 0, 338 dn Dobven se zraz može uvrstt u jednadžbu (55) Dobva se: n, , 338 n 0 v v n n dn Sljed: n, ,338 n 0 v v n n dn, te ntegrranje: v v,33035 n 0,338 n 3 n 3 Jednadžba daje ovsnost arcjalnog molarnog volumena otaala o molaltetu otone m, odnosno kolčn dodane sol n Nakon uvrštavanja: v 8, 08, ,5 0, 338 0,5 55,56 3 dobva se: 3 - v 8,078 cm mol 3,, 54 Lteratura Izvor: Irvng M Klotz, Thomas F Young, Chemcal Thermodynamcs: Basc Theory and Methods, W A Benjamn Inc, New York, 964, str 55 Posebna lteratura: (ROGOŠIĆ, 03) Marko Rogošć, Kemjsko-nženjerska termodnamka (Nastavn tekstov), Fakultet kemjskog nženjerstva tehnologje Sveučlšta u Zagrebu (ntern tekst), Zagreb, 03 46
151 6 Parcjalne molarne entalje grafčko dferencranje Na temelju eksermentalnh odataka (tablca) zračunat relatvne arcjalne molarne entalje komonenata u vodenoj oton HCl molalteta m = 3 mol kg - ostukom grafčkog dferencranja dervranja Podac su rkazan kao entalje otaanja n mola lnovtog HCl u kg vode n /mol H M /kj 04,6 5,0 390,5 59,4 69,5 807,9 933,4 078, 6 Entalja arcjalna molarna entalja Entalja všekomonentnh sustava ovs, r stalnom tlaku temeratur, o sastavu sustava, r čemu ta ovsnost uključuje dornose čsth komonenata, al tolnske efekte do kojh dolaz r njhovom mješanju U slučaju všekomonentnh sustava dealnog onašanja tolnsk efekt mješanja je nula, a entalja, H, je adtvna velčna, što se rkazuje jednadžbama: H d nk = nh, (6) = h d nk = xh, (6) = h je molarna entalja, n kolčna (množna) tvar, a x molarn udo komonente U realnm sustavma vrjede, ak, matematčk analogne jednadžbe: H nk = nh, (63) = nk h= xh (64) = Defncjska jednadžba arcjalne molarne entalje jest: H h = n T,, nj (65) 6 Entalja mješanja eksces entalja Asolutn je znos entalje nemoguće odredt, a je rkladno radt s relatvnm velčnama Osm toga, sa stajalšta rakse ključna je romjena entalje do koje dolaz r nekom rocesu Tako se, nr romjena entalje r mješanju, l entalja mješanja defnra kao razlka entalja sustava nakon rje mješanja komonenata (otaanja): nk M H H nh = =, (66) 47
152 nk M h h xh = = (67) Na slkama 6 6 rkazan su osnovn odnos zmeđu molarne entalje smjese, molarnh entalja čsth tvar, molarne entalje mješanja te arcjalnh molarnh entalja u realnom dvokomonentnom sustavu h h h h M x h + x h h h h x = x =0 x =0 x = Slka 6 Odnos molarne entalje sustava, molarnh entalja čsth komonent, molarne entalje mješanja, molarne eksces entalje arcjalnh molarnh entalja u realnom dvokomonentnom sustavu h-x djagram h M h h 0 h M h h x = x =0 x =0 x = Slka 6 Odnos molarnh entalja čsth komonent, molarne entalje mješanja, molarne eksces entalje arcjalnh molarnh entalja u realnom dvokomonentnom sustavu h M -x djagram 63 Relatvna entalja relatvna arcjalna molarna entalja Entalje se načelno određuju na temelju kalormetrjskh mjerenja (mjer se tolna otaanja /l tolna razrjeđenja) Eksermentom se ne može odredt asolutn znos entalje, već relatvn znos entalja, u odnosu na neko, rkladno odabrano standardno stanje U raks se tako najčešće korste dva standardna stanja, stanje čste komonente stanje beskonačno razrjeđene otone 48
153 I arcjalna molarna entalja se zražava kao relatvna velčna u odnosu na odabrano standardno stanje U rvom slučaju, kada je standardno stanje čsta tvar, standardna vrjednost arcjalne molarne entalje je grančna vrjednost dferencjalnog kvocjenta (64) za x koj tež jednc Ta grančna vrjednost je zaravo molarna entalja čste komonente, h U asmetrčnm sustavma, gdje je moguće razlkovat otaalo (komonenta ) od otoljene tvar (komonenta ), uravo je za otaalo rkladan ovaj zbor standardnog stanja Na taj načn određena relatvna arcjalna molarna entalja otaala defnra se zrazom: ( ) x l = h h = h h (68) Za otoljenu tvar je rkladnje odabrat beskonačno razrjeđenu otonu kao standardno stanje, jer se mjerenja u odručju malh koncentracja otoljene tvar vrlo brzo djelotvorno rovode, a je rezultate lako ekstraolrat na beskonačno razrjeđenje (n x teže u nulu) Relatvna arcjalna molarna entalja otoljene tvar defnra se zrazom: ( ) x l = h h = h h (69) 0 Na slkama lustrrana je razlka zmeđu dvju defncja relatvne arcjalne molarne entalje h h l l h h h l h x = x =0 x =0 x = Slka 63 Odnos molarne entalje sustava, molarnh entalja čsth komonent, arcjalnh molarnh entalja relatvnh arcjalnh molarnh entalja u realnom dvokomonentnom sustavu h-x djagram 49
154 h M l l l 0 x = x =0 x =0 x = Slka 64 Odnos molarne entalje mješanja, arcjalnh molarnh entalja relatvnh arcjalnh molarnh entalja u realnom dvokomonentnom sustavu h M -x djagram 64 Integralna entalja otaanja Integralna entalja otaanja je tolnsk efekt do kojeg dolaz otaanjem određene kolčne lna (l čvrste tvar) u određenoj kolčn otaala Prema slc 6, molarna entalja asmetrčnog sustava može se skazat kao zbroj standardne lnje entalje mješanja: h xh x h h M = + +, (60) z čega, nakon množenja s ukunom kolčnom tvar sljed: H nh n h H M = + + (6) Dferencranjem rema (65) uz stalan tlak, temeraturu kolčnu otaala n dobva se: h h H = n T,, n M H = h + n T,, n, (6) (63) Objema stranama rethodne jednadžbe može se, međutm, oduzet član h : M H = + n T,, n h h h h (64) Treba reoznat da se na ljevoj stran ojavla relatvna arcjalna molarna entalja otoljene tvar, a na desnoj stran njezn grančn znos, relatvna arcjalna molarna entalja koju b otoljena tvar mala kada b mogla ostojat kao čsta kaljevna r eksermentalnm uvjetma: 50
155 M H = l + n T,, n l (65) Kada se otona rblžava beskonačnom razrjeđenju, tada se arcjalna molarna entalja otoljene tvar rblžava svome grančnom znosu, h, što znač da se relatvna arcjalna molarna entalja otoljene tvar, rema (69), rblžava nul: lm l = 0 (66) n 0 Prmjenom stog grančnog uvjeta na desnu stranu jednadžbu (64) dobva se: lm H + = H + lm = 0, (67) M M l l n 0 n n 0 n T,, n T,, n odnosno: l M H = lm n 0 n T,, n (68) Nacrta l se ovsnost omjera dferencjala (ΔH M /Δn ) o kolčn otoljene tvar, uz stalnu kolčnu otaala (što je uobčajeno u kalormetrjskm mjerenjma), tada se relatvna arcjalna molarna entalja čste otoljene tvar, l može dobt ekstraolacjom na beskonačno razrjeđenu otonu Iz stog djagrama nterolacjom se dobje ( H M / n ), a rmjenom jednadžbe (65) nje teško zračunat l Za određvanje relatvne arcjalne molarne entalje otaala, l, rkladno je rmjent odgovarajuću Gbbs-Duhemovu jednadžbu, koja glas: ndl ndl 0 + = (69) Preuređvanjem se dolaz do relacje: l ndl n l l = (60) Prema jednadžb (65), ovsnost l o kolčn otoljene tvar sadrž konstantn član, l član s arcjalnm dferencjalnm kvocjentom Dferencranjem o n stoga se načelno dobva: l H H n n n n n M M = l + = T,, n T,, n T,, n (6) Dferencjaln kvocjent je, međutm, najčešće jednostavna lnearna funkcja kolčne otoljene tvar n, s odsječkom l nagbom A Stoga vrjed: M H = ( l + An) = A (6) n n n T,, n Vrjed stoga: l n T,, n = A, (63) 5
156 Odnosno: l = A n (64) Zamjenom varjable u ntegralu (60) dolaz se do: n nadn n 0 l =, (65) odnosno: A n l = (66) n 65 Rješenje zadatka Prmjenu ostuka grafčkog dervranja dferencranja za relatvne molarne entalje defnra nr (KLOTZ, 008) Rješenje se sastoj se od nekolko koraka Postavljanje baze roračuna U ovom se slučaju kao baza roračuna odabre fksna masa otaala, kg vode U tom slučaju, kolčna vode je stalna, znos: n m 55,56 mol = = = M 0,08 Mješanjem jednog klograma (55,56 mol) vode n mola HCl ostže se tolnsk efekt z tablce rkazane u zadatku, dakle, zadatak rkazuje ovsnost entalje mješanja o kolčn dodanog lna Izračunavanje rrasta kolčne Grafčko dferencranje dervranje zahtjeva zračunavanje rrasta kolčne komonente zmeđu dvju susjednh eksermentalnh točk Na rmjeru rve dvje točke dobva se: ( ) ( ) Δ n = n n = 3 = mol, + a za sve točke dobva se: = = =3 =4 =5 =6 =7 =8 Δn /mol Izračunavanje rrasta relatvne entalje Grafčko dferencranje dervranje zahtjeva zračunavanje rrasta relatvne entalje zmeđu dvju susjednh eksermentalnh točk Za rve dvje točke dobva se: ( ) ( ) Δ H = H H = 5,0 ( 04,6) = 46,4 kj M M M + Za sve točke odac su rkazan tablčno: 5
157 = = =3 =4 =5 =6 =7 =8 ΔH M /kj 46,4 39,5 8,9 73, 5,4 5,5 44,8 4 Izračunavanje omjera rrasta Prred se omjer dvaju rrasta; za rve dvje točke: ΔL 46,4 = = 73, kj mol Δn, te za sve točke tablčno: = = =3 =4 =5 =6 =7 =8 ΔH Δn M /(kj mol - ) 73, 69,8 64,5 57,7 38,5 4,8 36, 5 Grafčk rkaz Prred se graf (ΔH M /Δn ) = f(n ) tako da se crta stalan rrast od jedne do druge eksermentalne točke (steenast djagram) Graf je rkazan na slc 65 H M - ( Δ / Δn )/(kj mol ) l M - ( H / n)/(kj mol ) n /mol M A=tg α= ( H / n)/ n -60 M ( H / n ) -70 -l Slka 65 Grafčk rkaz rrasta, odnosno rrasta entalje mješanja o kolčn otoljene tvar uz stalnu kolčnu ( kg = 55,56 mol) otaala Iz grafčkog rkaza očtavaju se nagb, odsječak, te znos dferencjalnog kvocjenta za željen sastav otone 6 Očtavanje odataka s grafa Prema jednadžb (68), grančna vrjednost dferencjala očtava se s djagrama: H M = lm = ( 78,07) = 78,07 kj mol n 0 n T,, n l 53
158 Zadatak zahtjeva zračunavanje relatvne arcjalne molarne entalje komonenata u vodenoj oton HCl molalteta m = 3 mol kg - Buduć da se odac odnose na kg otaala, kolčna otoljene tvar o znosu je jednaka molaltetu: n = 3 mol Za zadan sastav očtava se znos dferencjala s djagrama: H n M T,, n = 70,4kJ mol Nagb otmalnog ravca kroz eksermentalne odatke je, također s djagrama, rema (63): M H A = =,5599 kj mol n n T,, n 6 Izračunavanje relatvnh arcjalnh molarnh entalja Prema jednadžb (65), relatvna arcjalna molarna entalja otoljene tvar za otonu zadana sastava je: l M H = l + = 78,07 + ( 70, 4) = 7, 6796 kj mol n T,, n Prema jednadžb (66), relatvna arcjalna molarna entalja otoljene tvar za otonu zadana sastava je: A n, = = = 0, kj mol n 55,56 l 66 Lteratura Izvor: Irvng M Klotz, Thomas F Young, Chemcal Thermodynamcs: Basc Theory and Methods, W A Benjamn Inc, New York, 964, str 83 Posebna lteratura: (KLOTZ, 008) Irvng M Klotz, Robert M Rosenberg, Chemcal Thermodynamcs: Basc Concets and Methods, 7 zd, Wley, New York,
159 7 Parcjalne molarne entalje emrjska funkcja Entaljsk efekt r otaanju n mola tvar A u 000 g vode može se rkazat emrjskom ovsnošću: M H 40 m 30 m = + kj mol kg mol kg Treba zračunat relatvne arcjalne molarne entalje obju komonenata u vodenoj oton molalteta m = 0,5 mol kg -, rmjenom Gbbs-Duhemove jednadžbe 7 Oće naomene o zadatku Ovaj je zadatak koncetualn Rješenje zadatka tjesno je ovezano s zlaganjem z odjeljka 6 Razlka je u tome što je ovdje funkcjska ovsnost entalje mješanja o molaltetu zadana jednadžbom mjesto tablčno 7 Rješenje zadatka Izračunavanje relatvne arcjalne molarne entalje otoljene tvar zasnva se na zrazu: M H = l + n T,, n l (7) S obzrom da je masa otaala kg, kolčna otoljene tvar o brojčanom je znosu jednaka molaltetu Stoga vrjed emrjsk zraz: M H n n = kj mol mol Dferencjal o kolčn otoljene tvar jest: H n H n M = ( 40n + 30n) = n =, n M = n Iznos dferencjalnog kvocjenta za sastav otone z zadatka: m = 0,5 mol kg -, odnosno n = 0,5 mol je: H n M = ,5 = 70 kj mol Grančna vrjednost relatvne molarne entalje otoljene tvar, l, zračunava se rema: M H l = lm (7) n 0 n T,, n Nakon uvrštavanja dobva se: 55
160 l n ( n ) = lm = 40 kj mol 0 Iz jednadžbe (7) sljed znos relatvne arcjalne molarne entalje otoljene tvar za otonu zadana sastava: H M = l + = = 30 kj mol n,, l T n Za određvanje relatvne arcjalne molarne entalje otaala, l, korst se Gbbs-Duhemova jednadžba: ndl ndl 0 + = (73) Preuređvanjem jednadžbe dolaz se do relacje: l ndl n l l = (74) Namjera je rjeć s varjable ntegrranja l na varjablu n Za to će oslužt dferencjal zraza (7): M l H = l + n n n Prv član u zagrad na desnoj stran je konstantan, stoga se može sat: M l H = n n n Međutm, dferencjaln kvocjent (rva dervacja entalje mješanja o kolčn otoljene tvar) već je određen Sljed stoga: l n = + n ( 40 60n ), l n = 60 kj mol, l = 60 n Dobven se zraz sada može uvrstt u (74): n l = n ( 60 n ) n 0 Nakon ntegrranja dobva se: 60 n l = n Kolčna otaala je: n m = = = 55,56 mol M 0,08 56
161 Uvrštavanjem u zraz za relatvnu arcjalnu molarnu entalju otaala dobva se: 60 0,5 55,56 = = 0,34989 kj mol l 73 Lteratura Izvor: Irvng M Klotz, Thomas F Young, Chemcal Thermodynamcs: Basc Theory and Methods, W A Benjamn Inc, New York, 964, str 84 Posebna lteratura: (KLOTZ, 008) Irvng M Klotz, Robert M Rosenberg, Chemcal Thermodynamcs: Basc Concets and Methods, 7 zd, Wley, New York,
162 8 Parcjalne molarne entalje rvdne molarne velčne Na osnov zmjerenh entalja razrjeđenja nza vodenh otona HCl razlčth koncentracja treba zračunat relatvne arcjalne molarne entalje obju komonenata, ostukom rvdnh molarnh velčna Podac su rkazan tablcom: Redn Broj Sastav očetne otone I mol HCl + 3 mol H O II mol HCl + 3 mol H O III mol HCl + 3 mol H O IV mol HCl + 5 mol H O V mol HCl + 5 mol H O VI mol HCl + 5 mol H O VII mol HCl mol H O Dodana kolčna vode Sastav konačne otone mol H O mol HCl + 5 mol H O 9 mol H O mol HCl + mol H O mol H O mol HCl + 5 mol H O 5 mol H O mol HCl + 50 mol H O 75 mol H O mol HCl + 00 mol H O 375 mol H O mol HCl mol H O 00 mol H O mol HCl mol H O Entaljsk efekt razrjeđenja 796,5 J 354,3 J 5690,0 J 0,4 J 69, J 97,0 J 380,7 J 8 Oće naomene o zadatku Tabelran odac o entaljama razrjeđenja HCl otječu z lterature (ROSSINI, 93) Zadatak je razrado Klotz Rosenberg u svome udžbenku (KLOTZ, 008) 8 Prvdna molarna entalja relatvna entalja Pr kalormetrjskm mjerenjma koja se rovode razrjeđvanjem, a ne otaanjem, rkladno je rabt tzv rvdne molarne velčne Prvdna molarna entalja otoljene tvar ĥ u asmetrčnom dvokomonentnom sustavu defnra se zrazom: H = nh + n h ˆ, (8) l u ntenzvnom oblku jednadžbom: h= xh + x h ˆ (8) Dakle, na nek se načn retostavlja da se otaalo (komonenta ) ne mjenja r rocesu otaanja, a da svu nedealnost sustava nos otoljena tvar Ekstenzvna entalja sustava ovezuje se s arcjalnm molarnm entaljama komonenata zrazom: 58
163 H = nh + nh (83) Entalja z jednadžb (8) (83) jednaka je: nh + nh = nh + nh ˆ (84) Na ovaj je načn ovezana rvdna molarna entalja otoljene tvar arcjalne molarne entalja komonenata: ˆ nh + nh nh h = (85) n S rblžavanjem beskonačnom razrjeđenju, arcjalna molarna entalja otaala rblžava se molarnoj entalj čstog otaala: lm h = (86) x 0 h Stoga se može sat: lm hˆ x 0 = h (87) (Za defncju h vdjet slku 63) Grančna vrjednost h eksermentalno je odredva onovljva Stoga je rvdnu molarnu entalju, ĥ, arcjalnu molarnu entalju, h, rkladno relatvzrat s obzrom na h Dobvaju se relatvna rvdna molarna entalja: l ˆ = hˆ h, (88) odnosno relatvna arcjalna molarna entalja otoljene tvar: l = h h (89) S druge strane, arcjalna molarna entalja otaala uobčajeno se relatvzra s obzrom na molarnu entalju čstog otaala, h Relatvna arcjalna molarna entalja otaala je: l = h h (80) Zato se zraz (84) može revest u međuovsnost relatvnh velčna Uvrštavanjem (88 0) dobva se: ( + ) + ( + ) = + ( ˆ + ) n l h n l h nh n l h, (8) nakon sređvanja: nlˆ = nl+ nl (8) Iz oblka dobvene jednadžbe očto je da je rodukt na ljevoj stran zraza matčna, osnovna ekstenzvna velčna za relatvne arcjalne molarne entalje Ta se velčna nazva (ekstenzvnom) relatvnom entaljom otone, L: L= n l ˆ (83) 59
164 83 Integralna entalja razrjeđenja Prema jednadžbama (8) (83), relatvna arcjalna molarna entalja otoljene tvar može se rkazat zrazom: ( nlˆ ) L ˆ ˆ l l l n = = = + n n n n n n (84) Uvrštavanjem te jednadžbe natrag u (8) dolaz se do zraza za relatvnu arcjalnu molarnu entalju otaala: n lˆ l = n n n (85) Dva navedena zraza osnova su određvanju arcjalnh molarnh entalja otoljene tvar otaala reko rvdnh molarnh velčna Dakle, da b zračunal l, odnosno l, treba oznavat ˆl njenu ovsnost o sastavu Prvdna molarna entalja otoljene tvar može se odredt z ntegralnh entalja razrjeđenja, tj tolnskh efekata do kojh dolaz razrjeđenjem otone čstm otaalom Proces razrjeđenja se može osat zrazom: r II I H = H H (86) Entalja očetne otone je: H = nh + nh Entalja n ' mola vode za razrjeđenje je: H = nh Entalja očetnog stanja stoga je: = + + I H nh nh nh Entalja konačnog stanja (nakon razrjeđenja) je: ( ) = + + II H n n h nh Entaljska romjena r razrjeđenju je: ( ) = (87) r H n n h nh nh nh nh Parcjalne molarne entalje mogu se zamjent odgovarajućm relatvnm vrjednostma, z (89) (80) Nakon skraćvanja sređvanja dobva se: ( ) (88) r H = n+ n l+ nl nl + nl U rethodnm jednadžbama n je kolčna čstog otaala kojm se razrjeđuje otona, l l su relatvne arcjalne molarne entalje otaala otoljene tvar rje, a l l nakon razrjeđenja Jednadžba (88) zaravo je razlka (ekstenzvnh) relatvnh entalja oslje rje razrjeđenja, rema (8), odnosno (83): 60
165 = (89) r H L L U skladu s (83), relatvna entalja se zražava kao rodukt kolčne relatvne rvdne molarne entalje otoljene tvar, a se rethodn zraz može sat kao: r H = n lˆ n lˆ (80) U rocesu razrjeđenja ne mjenja se kolčna otoljene tvar, n Stoga je rkladno rezultate eksermenta rkazat u odnosu na kolčnu otoljene tvar, tj o molu otoljene tvar: H h = = l l (8) r ˆr ˆ ˆ n = konst n Ekserment se uobčajeno sastoj od uzastonog razrjeđvanja otone očetne kolčne otoljene tvar, n, sve većm kolčnama otaala mjerenjem odgovarajućh tolnskh efekata Tolnsk se efekt mogu sumrat, jer je entalja velčna stanja, a se eksermentaln rezultat mogu rema otreb rkazat kao ovsnost ĥ r o molarnom udjelu otoljene tvar, x, l molaltetu otone, m S ovećanjem kolčne ukuno dodana otaala, tj s rblžavanjem beskonačnom razrjeđenju (x 0, m 0), ntegralna tolna otaanja, zražena o molu otoljene tvar, rblžava se konstantnoj, konačnoj vrjednost Vrjed zraz: ( ) ( ) lm hˆ = lm lˆ lˆ = lm lˆ lˆ (8) r n = konst x x x No, s rblžavanjem beskonačnom razrjeđenju, relatvna rvdna molarna entalja otoljene tvar, ^l rblžava se nul, što sljed z jednadžb (87) (88): lm lˆ = 0 (83) x 0 Stoga vrjed, z (8): lˆ = lm h ˆ n = (84) r konst x 0 Dakle, relatvna rvdna molarna entalja otoljene tvar u oton određenog sastava jednaka je negatvnoj grančnoj vrjednost ntegralne entalje razrjeđenja te otone (zražene o molu otoljene tvar) 84 Rješenje zadatka Postavljanje baze roračuna Formulacja zadatka okazuje da je otona s maksmalnom koncentracjom otoljenog HCl u skuu eksermentalnh odataka očetna otona s mol HCl 3 mol H O Sve se ostale otone mogu rremt razrjeđvanjem, u jednom l vše koraka, te osnovne otone Izračunavanje ntegralne entalje razrjeđenja Otone I, II III dobju se drektnm razrjeđvanjem očetne otone Otona IV dobje se razrjeđvanjem otone III s 5 mol H O To znač da je ukun entaljsk efekt razrjeđvanja jednak zbroju entaljskh efekta za ekserment III IV: 6
166 ( ) ( ) ( ) r r r H IV, kumulatvno = H III + H IV = 5690,0 0,4 = 67,4 J Na slčan načn reoznaje se sljedeće: ( ) ( ) ( ) r r r H V, kumulatvno = H III + H V = 5690,0 69, = 7309, J, ( ) ( ) ( ) r r r H VI, kumulatvno = H III + H VI = 5690,0 97,0 = 7987,0 J, ( ) ( ) ( ) ( ) r r r r H VII, kumulatvno = H III + H VI + H VII = 5690,0 97,0 380,7 = 8367,7 J, Na ovaj je načn rremljena tablca kumulatvnh entaljskh efekata razrjeđenja: Broj I II III IV V VI VII H r /J 796,5 354,3 5690,0 67,4 7309, 7987,0 8367,7 3 Izračunavanje molarne ntegralne entalje razrjeđenja Molarna ntegralna entalja razrjeđenja zračunava se djeljenjem ntegralne entalje razrjeđenja s (konstantnom) kolčnom otoljene tvar, jednadžba (8) U rkazanom je eksermentu kolčna otoljene tvar stalna znos n = mol Stoga je molarna ntegralna entalja razrjeđenja za otonu I: ˆ H 796,5 h = = = =, r r n konst 796,5 J mol n te za sve otone: Broj I II III IV V VI VII h = /(J mol - ) 796,5 354,3 5690,0 67,4 7309, 7987,0 8367,7 r ˆn konst 4 Određvanje relatvne rvdne molarne entalje otoljene tvar u očetnoj oton Prema jednadžb (84), relatvna rvdna molarna entalja otoljene tvar u očetnoj oton određuje se kao grančna vrjednost na rkazu ovsnost molarne ntegralne entalje razrjeđenja o sastavu otone Prkladna mjera sastava za elektroltske otone jest kvadratn korjen molalteta Molaltet je omjer kolčne otoljene tvar o mas otaala Za otonu I znos: n n m = = = =, mol kg m nm 5 0,08 Kvadratn korjen je: m = 3,333 mol kg Za sve otone znos su: Broj I II III IV V VI VII m/(mol kg - ), 4,63,, 0,56 0,4 0,03 m /(mol / kg -/ ) 3,33,5,49,05 0,75 0,37 0,9 6
167 Na slc 8 je grafčk rkaz ekstraolacje molarne ntegralne entalje razrjeđenja na beskonačno razrjeđenje otone h r ˆn = konst /(J mol - ) ,0 0,5,0,5,0,5 3,0 3,5 4,0 m / /(mol / kg -/ ) Slka 8 Molarna ntegralna entalja razrjeđenja kao funkcja sastava otone Varjabla sastava je kvadratn korjen molalteta Grančna vrjednost kad koncentracja otone tvar tež nul je relatvna rvdna molarna entalja otoljene tvar u očetnoj oton Iz grančne vrjednost rema slc sljed: lˆ ( ) = lm hˆ = 867,4 = 867,4 J mol r n = konst x 0 5 Određvanje relatvne rvdne molarne entalje otoljene tvar Relatvna rvdna molarna entalja otoljene tvar r svm koncentracjama može se odredt na osnov jednadžbe (8), zrazom: ˆ ˆ r l = h + l ˆ n = konst Za otonu I dobva se: lˆ = 796, ,4 = 475,9 J mol Za sve otone rezultat su: Broj I II III IV V VI VII ˆl /(J mol - ) 475,9 558, 98, , 685,4 304,7 63
168 6 Određvanje relatvne arcjalne molarne entalje otoljene tvar Relatvna arcjalna molarna entalja otoljene tvar određuje se na osnov zraza (84): l lˆ n lˆ = + n n Izraz zahtjeva oznavanje ovsnost relatvne rvdne molarne entalje otoljene tvar o sastavu, što je određeno u rethodnom koraku Sastav, međutm, treba reračunat na stalnu kolčnu otaala, n = konst, rmjenom zraza: n n = mol n Za otonu I dobva se: n = = 0, mol 5 Za sve otone rezultat su: Broj I II III IV V VI VII n /mol 0, 0, ,04 0,0 0,0 0,005 0,00065 Na slc 8 rkazana je ovsnost relatvne rvdne molarne entalje otoljene tvar o sastavu, skazanom kolčnom otoljene tvar o molu otaala Podac se mogu aroksmrat lnearnom funkcjom, s nagbom 54386, J mol ˆl /(J mol - ) ,00 0,05 0,0 0,5 0,0 0,5 n /mol Slka 8 Relatvna rvdna molarna entalja otoljene tvar kao funkcja sastava otone Varjabla sastava je kolčnom otoljene tvar o molu otaala Ovsnost je aroksmrana lnearnom funkcjom 64
169 Sljed zračunavanje rema (84) Za otonu I dobva se: lˆ l l n ˆ = + = 475,9 + 0, 54386, = 353, J mol n n Za sve otone odac su: Broj I II III IV V VI VII l /(J mol - ) 353, 9690,3 557,8 3047,7 907, 8,4 338,7 6 Određvanje relatvne arcjalne molarne entalje otaala Relatvna arcjalna molarna entalja otaala zračunava se rema (85) Za otonu I dobva se: n lˆ 0, l 54386, 75,33 J mol = = = n n n Za sve otone odac su: Broj I II III IV V VI VII l /(J mol - ) ,7 87,0,75 5,439 0,3399 0,04 85 Lteratura Izvor: Irvng M Klotz, Thomas F Young, Chemcal Thermodynamcs: Basc Theory and Methods, W A Benjamn Inc, New York, 964, str 87 Posebna lteratura: (KLOTZ, 008) Irvng M Klotz, Robert M Rosenberg, Chemcal Thermodynamcs: Basc Concets and Methods, 7 zd, Wley, New York, 008 (ROSSINI, 93) Frederck D Rossn, The Heat of Formaton of Hydrogen Chlorde and some Related Thermodynamc Data, Journal of Research of the Natonal Bureau of Standards 9 (93)
170 Equaton Secton 99 Test konzstentnost U sustavu metlckloheksan() toluen() zmjeren su r 00,0 C arametr ravnoteže ara-kaljevna, sastav kaljevte, odnosno arne faze ravnotežn tlak Prložen su ravnotežn tlakov čsth komonenata r naznačenoj temeratur: = 740,6 mmhg = 556,7 mmhg Treba zračunat koefcjente aktvnost obju komonenata za sve rkazane eksermentalne točke te grafčk, ntegralnm testom, testrat konzstentnost zmjerenh odataka, uz retostavku da se ara vlada kao dealn ln Eksermentom određen arametr ravnoteže su: x 0,00 0,00 0,400 0,600 0,800 0,900 y 0,5 0,77 0,478 0,650 0,8 0,908 /mmhg 593,8 64,5 670,6 705,6 77,6 735,6 9 Oća razmatranja o zadatku Eksermentalno određvanje ravnoteže ara kaljevna rovod se na dva osnovna načna U rvom načnu, r stalnom tlaku određuje se ravnotežno vrelšte te, uobčajeno, sastav arne kaljevte faze U drugom načnu kakv su odac z ovog zadatka, r stalnom se tlaku određuje ravnotežn tlak te sastav arne kaljevte faze Za rmjer dvokomonentnog, dvofaznog sustava, Gbbsovo ravlo faza daje dva stunja slobode To znač da je eksermentom, za svaku točku, otrebno odredt samo dva ravnotežna arametra (nr ravnotežn tlak sastav kaljevte faze); treć arametar (nr sastav arne faze) je však Ukolko se ak eksermentom neovsno određuje, tada može služt kao usoredbena varjabla r nr određvanju arametara modela koefcjenta aktvnost, slčno Eksermentaln odac o ravnotež ara kaljevna dalje omogućuju određvanje koefcjenta aktvnost komonenata, eksces Gbbsovh energja te zajedno s neovsnm mjerenjma r drugm temeraturama l ak neovsnm kalormetrjskm mjerenjma, još eksces entalja eksces entroja u sustavu 9 Integraln test konzstentnost Test konzstentnost rovod se da b se utvrdlo jesu l eksermentaln odac u skladu s osnovnm termodnamčkm zakontostma Ukolko r eksermentalnom određvanju nje ustnu ostgnuta fazna ravnoteža, l ak mjerenje sadrž sstematsku ogrešku, test konzstentnost neće bt zadovoljen, mjerenje se mora odbact kao moguć zvor za određvanje relevantnh termodnamčkh arametara stražvanog sustava U lteratur se navode razlčt oblc testa konzstentnost Međutm, sv se zvode z tzv ooćene Gbbs-Duhemove jednadžbe za eksces Gbbsovu energju koja glas: ex ex nk h v dt d ln 0 xd, (9) RT RT l za dvokomonentn sustav: ex ex h v dt d x d ln xd ln 0 (9) RT RT Eksces Gbbsova energja dvokomonentnog sustava je: 66
171 ex g xln xln (93) RT Totaln dferencjal zraza je: ex g ln ln ln ln d xd x d dx dx (94) RT Oduzmanjem jednadžbe (9) od (94), uz dx = dx, dobva se: ex ex ex g h v d ln dx dt d (95) RT RT RT Za zotermne odatke, out onh z redmetnog zadatka, vrjed: ex g ln RT ex v d dx d (96) RT K tome je v ex o asolutnoj vrjednost raktčk zanemarv u usoredb s roduktom RT, a se bez velke ogreške može sat: ex g d ln dx (97) RT Integraln test konzstentnost (HERRINGTON, 95) u slučaju zotermnog eksermenta zvod se z rethodne jednadžbe Jednadžba se ntegrra u grancama od x = 0 do x = : x ex x g d ln dx RT (98) x0 x0 Integral ljeve strane jednak je nul, jer je eksces Gbbsova energja za čste komonente kao grance ntegracje o defncj jednaka nul Stoga ntegral desne strane treba bt jednak nul: x ln dx 0 x 0 (99) Prethodn je zraz osnovna jednadžba ntegralnog testa konzstentnost, koj se može lustrrat slkom 9 67
172 ln 0 0 x Slka 9 Integraln test konzstentnost Ovaj se test rovod tako da se rrede djagram ovsnost ln( /l-l ln( / ) o x Eksermentalne točke mogu se aroksmrat rkladnom funkcjom, koja se može numerčk ntegrrat Integral funkcje trebao b bt što blž nul, tj oztvn do ovršne koju funkcja zatvara s ascsom trebao b bt rblžno jednak njenom negatvnom djelu 93 Rješenje zadatka U rvom koraku treba zračunat molarne udjele komonente u arnoj kaljevtoj faz, jednostavno rema: x x, odnosno: y y Zatm se računaju koefcjent aktvnost Jednadžba fazne ravnoteže ara kaljevna, skazana reko K-vrjednost (koefcjenta rasodjele), za slučaj kada se ara vlada dealno, glas: K L L y v ex (90) x RT Za komonente maloga rasona ravnotežnh tlakova, odnosno blskh vrelšta, eksonencjaln član (Poyntngov faktor) može se zanemart jer je: L v RT Vrjed stoga: L y, (9) x z čega sljed: y x, (9) L odnosno: 68
173 L y (93) x To je zraz za zračunavanje koefcjenta aktvnost komonenata z rasoložvh odataka o ravnotež ara kaljevna je ravnotežn tlak čste komonente r temeratur eksermenta Zadan je zadatkom Za rvu eksermentalnu točku dobva se: y 0,5 593,8, 87, 0,00 740,6 L x y 0, ,8, , , 7 L x Podac za sve eksermentalne točke su: x 0,9 0,8 0,6 0,4 0, 0, y 0,848 0,73 0,5 0,35 0,79 0,09,87,6788,0805,034,0084,0008,0050,038,048,0904,6975,565 Integraln test konzstentnost odrazumjeva rremu djagrama ovsnost ln( / ) o x, na osnov jednadžbe (99) Tablca s odacma je: x 0,00 0,00 0,400 0,600 0,800 0,900 ln( / ) 0,979 0,4468 0, , ,4859-0,9303 Djagram je rkazan na slc 9 0,6 ln( / ) 0,4 0, 0,0 0, 0,4 0,6 0,8,0-0, x -0,4-0,6 Slka 9 Integraln test konzstentnost za redmetn zadatak Integraln test konzstentnost odrazumjeva ntegrranje, tj zračunavanje ovršne označene crvenom bojom Za ntegrranje se može rmjent traezna formula Naravno, oželjno je uključt točke ekstraolrane na os čsth komonent, al ekstraolacja je rjetko ouzdana, jer je ovsnost ln( / ) o x često zakrvljena r x 0, odnosno x 0 69
174 Integral se za otrebe rješenja ovoga zadatka može zračunat traeznom formulom, detaljno osanom u odjeljku (93) Osnovna formula ntegrranja traeznom formulom je (96): b n a A f x dx x x f x f x Formula u ovom slučaju glas: ln ln A x x Za rvu ovršnu traeza dobva se: 0,979 0,4468 A 0, 00 0,00, A 0, 0679 Površne ostalh segmenata su: A 0, , A3 0, , A4 0, 0045, A5 0, Ukuna ovršna je: A 0, , , , 00450, 0045, A 0, Komentar rješenja Ukuna ovršna rblžava se nul, dakle moglo b se zaključt da su odac termodnamčk konzstentn Međutm, za bolju rosudbu trebalo b uključt rubne odatke, kad x 0, odnosno x 0 95 Lteratura Posebna lteratura: (HERRINGTON, 95) E F G Herrngton, Test for the consstency of exermental sobarc vaour lqud equlbrum data, Journal of the Insttute of Petroleum 37 (95)
175 Equaton Secton 3030 Standardna stanja kod ravnoteže ara kaljevna Izračunat koefcjente aktvnost obju komonenata u sustavu kloroform() aceton() za otonu sastava x = 0,543 r temeratur od 35,7 C, na temelju mjernh odataka (tablca), ako je standardno stanje: a) čsta tvar, b) beskonačno razrjeđena otona Grafčk rkazat ovsnost ukunog tlaka arcjalnh tlakova o sastavu sustava Eksermentom određen arametr ravnoteže su: x 0 0,0588 0,3 0,853 0,970 0,543 0,7997 0,975,0 /mmhg 0 9, 0,4 3,9 55,4 7,8 4,4 67, 93, /mmhg 344,5 33, 99,3 75,4 30,3 35,0 37,5 3, Oća razmatranja o zadatku Eksermentom su određen arametr ravnoteže ara kaljevna r stalnoj temeratur Podacma je okrveno cjelo odručje sastava, uključujuć čste komonente, tako da su rubn tlakov zaravo ravnotežn tlakov čsth komonenata U slučaju da odac ne uključuju čste komonente, ravnotežn se tlakov mogu zračunat z emrjskh jednadžb krvulja saravanja dostunh u lteratur, out Antoneove l Wagnerove Sustav kloroform() aceton() sadrž dvje komonente razmjerno blskh vrelšta (slčnh tlakova ara) Vrelšte kloroforma r atmosferskom tlaku je 6, C, a acetona 56,0 C Komonente su kemjsk dovoljno razlčte da ne tvore dealnu otonu K tome, u dvokomonentnoj smjes dolaz do nastanka vodkovh veza razmjerno kselog vodka u kloroformu slobodnh elektronskh arova kskova atoma z acetona Vodkove veze ne ostoje u čstm komonentama Nastale vodkove veze snžavaju ukunu energju sustava, však energje se r mješanju oslobađa u oblku tolne, a smjesa okazuje oztvna odstuanja od Raoultova zakona razmjerno rjedak azeotro s maksmumom vrelšta, odnosno s mnmumom tlaka ara 30 Jednadžba fazne ravnoteže ara kaljevna Jednadžba fazne ravnoteže ara kaljevna može se zvest z jednakost arcjalnh fugactvnost komonenata u dvjema rsutnm fazama: ˆV ˆL f f (30) Za arnu fazu, može se sat: ˆ V V f ˆ y, (30) jer je arcjalna fugactvnost komonente rodukt arcjalnog koefcjenta fugactvnost, ˆV, arcjalnog tlaka: y, (303) 7
176 Ravnotežn tlak u redmetnom sustavu je sod olovce atmosferskog u cjelom odručju sastava Rad se, dakle, o razmjerno nskom tlaku U takvm se sustavma može retostavt dealno vladanje arne faze Vrjed stoga: V ˆ, (304) f V ˆ y (305) Za kaljevtu se fazu može sat: f af L L ˆ, (306) jer je aktvnost komonente, a, jednaka omjeru arcjalne fugactvnost fugactvnost u standardnom stanju Jednadžba fazne ravnoteže stoga je, u redmetnom sustavu: y a f L, (307) Aktvnost komonente se, međutm, ovezuje s molarnm udjelom komonente u kaljevn, x, reko koefcjenta aktvnost: a (308) x Vrjed stoga: yx f L (309) Iznos koefcjenta aktvnost ovs o zboru standardnog stanja 303 Čsta kaljevna kao standardno stanje Jednadžba (309) zahtjeva zračunavanje fugactvnost kaljevne u standardnom stanju Ako je standardno stanje čsta kaljevna, njena se fugactvnost zračunava z oznath fugactvnost čste kaljevne, odnosno are r temeratur sustava odgovarajućem ravnotežnom tlaku (name tamo gdje su te fugactvnost jednake Izračunavanje je shematsk rkazano na slc 30 Standardna se fugactvnost zračunava kao rodukt ravnotežne fugactvnost čste komonente, f, Poyntngova faktora, PF : f f PF (300) L Poyntngov faktor zračunava se rema: PF ex RT što daje: L v d, (30) L L f f ex v d RT, (30) odnosno, uz molarn volumen čste kaljevne, v L, koj ne ovs o tlaku: 7
177 f L f L v ex RT (303) f ( ) S L K ( f ) TT V Slka 30 Shematsk rkaz zračunavanja standardne fugactvnost čste kaljevne Standardno stanje za kaljevnu je stanje r tlaku temeratur sustava, T Ravnotežn tlak nalaz se na krvulj saravanja Fugactvnost u standardnom stanju f jednaka je roduktu ravnotežne fugactvnost f Poyntngova faktora za kaljevnu T Poyntngov se faktor može zanemart u sustavma s malm rasonom ravnotežnh tlakova (sustavma blskh vrelšta) Podac za redmetn sustav okazuju da rason eksermentalnh tlakova nje revelk,, stoga je ( )v L á RT a je Poyntngov faktor rblžan jednc Tada se še: f L f (304) Ravnotežna fugactvnost čste kaljevne, odnosno are jednaka je roduktu koefcjenta fugactvnost ravnotežnog tlaka: f (305) Za kaljevne razmjerno nskh ravnotežnh tlakova, koefcjent fugactvnost jednak je jednc, a ravnotežna fugactvnost jednaka je ravnotežnom tlaku Stoga jednadžba fazne ravnoteže u tom slučaju glas: y x (306) U dealnm otonama koefcjent aktvnost jednak je jedan, jednadžba ravnoteže je Raoultov zakon: y x (307) Koefcjent aktvnost skazuje odstuanje arcjalnog tlaka komonente u realnom sustavu od njegova dornosa očekvana rema Raoultovu zakonu, kao je rkazano na slc 30 73
178 Raoult x x 0 0 x Slka 30 Koefcjent aktvnost kao odstuanje arcjalnog tlaka komonente u realnoj oton arcjalnog tlaka zračunatog rema Raoultovu zakonu 303 Beskonačno razrjeđena otona kao standardno stanje Prema jednadžb (309), arcjalna fugactvnost komonente u realnoj oton može se zračunat rema: f xf ˆ L (308) Kako se udo komonente, smanjuje, x 0, koefcjent aktvnost rblžava se svojoj grančnoj vrjednost r beskonačnom razrjeđenju: U uvjetma beskonačnog razrjeđenja može se sat: f xf ˆ L (309) Izraz je formalno analogan Henryjevu zakonu: xk, (300) H ukolko se r dovoljno nskm tlakovma može retostavt da je arcjalna fugactvnost jednaka arcjalnom tlaku komonente Rad se o jednadžb ravca koja olaz z shodšta na os x = tvor odsječak k H, Henryjevu konstantu: k f L H (30) Taj odsječak defnra standardno onašanje Strktno formalno, dakle, standardno stanje je određeno ekstraolacjom onašanja r beskonačnom razrjeđenju na otonu jednčne koncentracje, ovdje jednčnog molarnog udjela Za otonu koja sljed takvo onašanje u cjelom odručju sastava kaže se da je dealna rema Henryjevu zakonu Ovakav zbor standardnog stanja uobčajen je r asmetrčnm otonama, rmjerce lnova u kaljevnama, gdje zbor čste tvar (čstog kaljevtog lna) kao standardnog stanja nje n moguć zbog toga što je otoljen ln u ravlu znatno znad krtčne temerature Međutm, nema formalne zareke da se takvo standardno stanje ne rmjen u smetrčnm otonama, out one z redmetnog zadatka Odstuanja od dealnost rema Henryjevu zakonu osuju se odgovarajućm koefcjentom aktvnost Parcjalna fugactvnost, rblžno jednaka arcjalnom tlaku komonente je: 74
179 fˆ x k, (30) H H Jednadžba fazne ravnoteže ara kaljevna tada je: y x k (303) H H Koefcjent aktvnost kao mjera odstuanja od Henryjeva zakona rkazan je na slc 303 k H Henry xk H H xk H 0 0 x Slka 303 Koefcjent aktvnost kao odstuanje arcjalnog tlaka komonente u realnoj oton arcjalnog tlaka zračunatog rema Henryjevu zakonu 303 Rješenje zadatka Čsta kaljevna kao standardno stanje Rješenje zahtjeva oznavanje ravnotežnh tlakova čsth komonenata, On se mogu zračunat z, rmjerce, Antoneove jednadžbe, l se ak mogu uzet eksermentaln odac, kao u redmetnom zadatku, z tablce: x 0 0,0588 0,3 0,853 0,970 0,543 0,7997 0,975,0 /mmhg 0 9, 0,4 3,9 55,4 7,8 4,4 67, 93, /mmhg 344,5 33, 99,3 75,4 30,3 35,0 37,5 3,0 0 x 93, mmhg, x 0 344,5 mmhg Crvenom je bojom označen odatak za komonentu, a zelenom za komonentu Koefcjent aktvnost zračunavaju se na osnov jednadžbe (306): y L x x Za otonu zadana sastava, x = 0,543, rezultat su: 75
180 L L x 0,543 7,8 x 0,54393, x 0,543 35, 0 x 0,543344,5 0,7847, 0,8068 Zadatak zahtjeva grafčk rkaz ovsnost ukunog tlaka arcjalnh tlakova o sastavu sustava Ukun tlak sustava zbroj je arcjalnh tlakova komonenata: Rezultat su rkazan u tablc: x 0 0,0588 0,3 0,853 0,970 0,543 0,7997 0,975,0 /mmhg 344,5 33,4 39,7 307,3 85,7 5,8 6,9 80, 93, Na slc 304 je zahtjevan grafčk rkaz 350 ( ) / mmhg ,0 0, 0,4 0,6 0,8,0 Slka 304 Ovsnost ravnotežnog tlaka sustava (crnom bojom) te arcjalnh tlakova komonente (crvenom bojom) komonente (zelenom bojom) o sastavu otone Lnje označavaju dealno onašanje rema Raoultovu zakonu x Beskonačno razrjeđena otona kao standardno stanje Jednadžba fazne ravnoteže ara kaljevna (303) daje: y H xk H xk H Zadatak dakle rvo zahtjeva zračunavanje (rocjenu) Henryjevh konstant za obje komonente Henryjeva konstanta zračunava se kao grančna vrjednost omjera arcjalnog tlaka komonente njenog molarnog udjela: 76
181 k H y lm lm (304) x x x0 x0 Ovdje se kao dobra aroksmacja beskonačno razrjeđene otone može uzet eksermentalna točka s najmanjom koncentracjom romatrane komonente U eksermentalnoj tablc otrebn odac za komonentu označen su crvenom, a za komonentu zelenom bojom: x 0 0,0588 0,3 0,853 0,970 0,543 0,7997 0,975,0 /mmhg 0 9, 0,4 3,9 55,4 7,8 4,4 67, 93, /mmhg 344,5 33, 99,3 75,4 30,3 35,0 37,5 3,0 0 Uvrštavanjem odataka dobje se: k k 9, H lm 56,463 mmhg, x 0 x 0,0588 H 3,0 lm lm 57,576 x0 x x0 x 0, 975 mmhg Koefcjent aktvnost rema Henryjevu zakonu (odnosno rema beskonačno razrjeđenoj oton kao standardnom stanju) tada su, za željen sastav otone: x 0,543 7,8 H xk H 0,54356,463 x 0,543 35,0,4639, H xk H 0,54357,576,7639 Grafčk rkaz ukunog tlaka arcjalnh tlakova sustava st je kao kod rethodne defncje standardnog stanja, jedno su lnje koje odgovaraju dealnom onašanju drugačje, slka 305 ( ) / mmhg ,0 0, 0,4 0,6 0,8,0 Slka 305 Ovsnost ravnotežnog tlaka sustava (crnom bojom) te arcjalnh tlakova komonente (crvenom bojom) komonente (zelenom bojom) o sastavu otone Lnje označavaju dealno onašanje rema Henryjevu zakonu x 77
182 304 Komentar rješenja Kako je već rečeno, djagram otkrvaju da se rad o razmjerno rjetkom azeotrou s mnmumom tlaka ara Prmjena beskonačno razrjeđene otone kao standardnog stanja nje uobčajena u smetrčnm sustavma, kada obje (sve) komonente ostoje kao čste kaljevne r temeratur (tlaku) sustava Stoga se taj do zadataka treba smatrat tek lustracjom Prmjena beskonačno razrjeđene otone kao standardnog stanja raktčna je kod asmetrčnh otona, rmjerce kod otona lnova l ak krutna, uključujuć elektrolte, u kaljevnama Podac otkrvaju da su koefcjent aktvnost rema dvjema defncjama dealnog onašanja u ravlu surotnog karaktera Ako sustav skazuje negatvna odstuanja rema Raoultovu zakonu, L <, tada su odstuanja rema Henryjevu zakonu oztvna, H > Izračunat koefcjent aktvnost rema Raoultovu zakonu omogućuju zračunavanje eksces Gbbsove energje sustava, rema: ex g RT xln xln, (305) te Gbbsove energje mješanja, rema: ln ln ln ln (306) M g RT x a x a RT x x x x Posebno se, uz ogrančenja osana u ovom sustavu (mal rason vrelšta, oćento nsk tlakov), može sat: g RT x ln x ln M (307) 305 Lteratura Izvor: Leonard C Labowtz, John S Arents, Physcal Chemstry Problems and Solutons, Academc Press, New York, 969, str 73 Posebna lteratura: (ROGOŠIĆ, 03) Marko Rogošć, Kemjsko-nženjerska termodnamka (Nastavn tekstov), Fakultet kemjskog nženjerstva tehnologje Sveučlšta u Zagrebu (ntern tekst), Zagreb, 03 (ZAWIDZKI, 900) Jean Wktor Thomasz von Zawdzk, Über de Damfdrucke bnärer Flüssgketsgemsche, Zetschrft für hyskalsche Cheme 35 (990)
183 Equaton Secton 33 Koefcjent aktvnost emrjska funkcja Koefcjent aktvnost komonente() u dvokomonentnoj oton ovs, r stalnom tlaku temeratur, o sastavu rema sljedećem emrjskom zrazu: ln ax bx cx 3 4 Parametr a, b c rtom ne ovse o sastavu Treba rredt zraze koj osuju ovsnost koefcjenta aktvnost komonente(), odnosno eksces Gbbsove energje o sastavu u stoj dvokomonentnoj oton 3 Oća razmatranja o zadatku Rad se o koncetualnom zadatku, bez uoršta u konkretnm eksermentalnm odacma Koefcjent aktvnost u dvokomonentnm sustavma mogu se odredt na osnov ravnoteže ara kaljevna Dobvena ovsnost koefcjenta aktvnost o sastavu može se okušat osat na osnov teorjskh modela koefcjenta aktvnost, al model mogu bt sasvm emrjske rrode, out jednadžbe rkazane u zadatku Vezu koefcjenta aktvnost komonenata daje Gbbs-Duhemova jednadžba, a zatm se jednostavno zračunava eksces Gbbsova energja 3 Redlch-Ksterov emrjsk olnomn model Na slc 3 rkazan su moguć oblc ovsnost eksces Gbbsove energje o sastavu dvokomonentnog sustava, skazanom molarnm udjelma g ex RT 0 0 x Slka 3 Shematsk rkaz eksces Gbbsove energje u dvokomonentnm kaljevtm sustavma uz smetrčnu defncju standardnog stanja Prema slc, eksces Gbbsova energjao defncj je jednaka nul za čste komonente (uz smetrčnu defncju standardnog stanja), a zmeđu može bt oztvna, negatvna, l čak mjenjat redznak Polnomn model koefcjenta aktvnost emrjska je olnomna funkcja koja orma vrjednost g ex /RT = 0 za x = 0 x = 0 Koefcjent olnoma određuju se z 79
184 eksermentalnh odataka Oć oblk takvog olnoma dal su Redlch Kster (REDLICH, 948) Polnom za eksces Gbbsovu energju glas: ex g xx ABxxCxx (3) RT Produkt x x sred uglate zagrade osgurava uvjet g ex /RT = 0 za x = 0 x = 0 Izraz za koefcjent aktvnost određuju se z oće jednadžbe: ex ex g g RT ln x k, (3) RT k xk T,, x jk, koja se za dvokomonentn sustav svod na: ex g ln x RT ex g ln x RT g g ex ex x RT x RT T, T,, (33) (34) Za troarametarsk Redlch-Ksterov model, nakon dferencranja dobva se: ln x AB 3xx C xx 5xx, (35) ln x AB x3x C xx x5 x (36) Izraz (35) se, nakon uvođenja zamjene: x x, svod na: ln A3B5C x 4B6C x Cx, 3 4 što je oblk sasvm usoredv s onm z teksta zadatka: ln ax bx cx 3 4 Rekonstrukcja zraza za eksces Gbbsovu energju z oznath zraza za koefcjent aktvnost jest: ex g xln xln RT (37) Na slc 3 rkazana je oćenta ovsnost reducrane eksces Gbbsove energje, g ex /RT, o sastavu dvokomonentnog sustava skazanom molarnm udjelma Slka te jednadžba (37) okazuju da je logartam koefcjenta aktvnost zaravo arcjalna molarna velčna koja odgovara reducranoj eksces Gbbsovoj energj, te se na logartam koefcjenta aktvnost može rmjent Gbbs-Duhemova jednadžba 80
185 g ex RT ln ln x 0 0 Slka 3 Prmjena metode odsječka na grafčko određvanje logartma koefcjenta aktvnost, ln z ovsnost reducrane eksces Gbbsove energje, g ex /RT, o sastavu dvokomonentnog sustava skazanom molarnm udjelom x Slka okazuje da je ln arcjalna molarna velčna za g ex /RT 33 Gbbs-Duhemova jednadžba za koefcjent aktvnost Vše o Gbbs-Duhemovoj jednadžb nalaz se u odjeljku 5 Gbbs-Duhemova jednadžba za koefcjent aktvnost zvod se z Gbbs-Duhemove jednadžbe za aktvnost: xd ln a 0, (38) Nakon zamjene: a x (39) Sljed: xdln x 0, (30) te: xd ln x xd ln 0 (3) Prva se suma na ljevoj stran ojednostavljuje Buduć je dlnx = dx /x, vrjed: xd ln x dx d x d 0 (3) Konačn zraz Gbbs-Duhemove jednadžbe za koefcjent aktvnost stoga je: xd ln 0 (33) Za dvokomonentnu otonu može se sat: xdln xdln 0, (34) x dln dln, (35) x 8
186 ln ln x dln dln x ln ln, (36) x x Buduć da je koefcjent aktvnost komonente jednak kad je x = (kada je komonenta čsta), logartam koefcjenta aktvnost jednak je nul a donja granca ntegracje na ljevoj stran jednadžbe ščezava Stoga se še: ln x d ln x ln x ln, (37) odnosno: ln x d ln x ln x ln (38) Ovaj osljednj zraz omogućuje zračunavanje koefcjenta aktvnost komonente z oznate ovsnost koefcjenta aktvnost komonente o sastavu 34 Rješenje zadatka Izraz z teksta zadatka: ln ax bx cx, 3 4 daje ovsnost logartma koefcjenta aktvnost komonente o sastavu skazanom molarnm udjelom komonente Za uvrštavanje u jednadžbu (38) zraz treba dferencrat o x : ln ax bx cx x x 3 4 ln 3 ax 3bx 4cx x Dobva se: d ln ax 3bx 4cx dx 3, Sljed uvrštavanje u (38), uz odgovarajuću romjenu varjable u grancama ntegrranja: x x 3 ln ax 3bx 4cxdx x x Izraz se rje ntegrranja ojednostavljuje: x ln x a3bx 4cx dx, x x 3 a b ax c bx cx dx x ln Integrranje se rovod u navedenm grancama: 8
187 3ba 4c3b 4c ln ax x x x Nakon uvrštavanja granca dobva se: 3ba 4c3b 3 4c 4 ln ax x x x 3 4 Prkladno je uvest zamjenu: x x, Da b se dobo zraz smetrčan očetnomu: 3b 8c 3 4 ln a cx b x cx 3 Eksces Gbbsova energja zračunava se z: ex g RT x ln x ln Nakon uvrštavanja: g ex b x ax bx cx x a c x c b x cx RT sređvanja: x 3, 3, g ex 3 3 b 8 3 xx ax bx cx a c x c b xcx RT te rkuljanja koefcjenta dolaz se do konačnoga zraza za eksces Gbbsovu energju: 3 ex g b c xx abc c x x RT Kako se vd z rješenja, zraz je jednak nul za obje čste komonente 35 Lteratura Izvor: Stanley I Sandler, Chemcal and Engneerng Thermodynamcs, Wley, New York, 990, str 335 Posebna lteratura: (REDLICH, 948) Otto Redlch, A T Kster, Algebrac Reresentaton of Thermodynamc Proertes and the Classfcaton of Solutons, Industral and Engneerng Chemstry 40 (948)
188 Equaton Secton 33 Aktvnost grafčko određvanje; Gbbs Duhem Izračunat aktvnost ttana u sustavu ttan() krom() sastava x = 0,60 u skladu s Gbbs- Duhemovom jednadžbom na temelju mjernh odataka određenh r temeratur od 50 C: a) zravno, b) utem koefcjenta aktvnost Mjern odac su: x 0,09 0,9 0,7 0,37 0,47 0,67 0,78 0,89 a 0,30 0,53 0,660 0,778 0,80 0,863 0,863 0,906 3 Oća razmatranja o zadatku U mnogm slučajevma eksermentalna ogrančenja douštaju određvanje aktvnost l koefcjenta aktvnost samo jedne od komonenata u všekomonentnom sustavu Gbbs- Duhemova jednadžba tada omogućuje zračunavanje aktvnost l koefcjenta aktvnost druge komonente Predmetn zadatak osuje takav rstu 3 Knudsenova metoda određvanja aktvnost Aktvnost komonente u metalnoj legur može se odredt na osnov brzne efuzje Efuzja je roces u kojem se ojednačne molekule gbaju kroz rocje bez međusobnh sudara molekula Do efuzje dolaz kada je romjer rocjea znatno manj od srednje slobodne utanje molekule Knudsenova metoda određvanja brzne efuzje zasnva se na aaratur rkazanoj na slc 3 Cahnova elektrovaga Zaslon rotv zračenja od nehrđajućeg čelka Rashladna voda Prema vakuumu Protuuteg Knudsenova efuzjska ćelja Elektrčna eć Termoar Slka 3 Knudsenova aaratura za određvanje brzne efuzje, rema (ITOH, 0) 84
Microsoft PowerPoint - 07b Ravnoteza para-kapljevina [Compatibility Mode]
![Microsoft PowerPoint - 07b Ravnoteza para-kapljevina [Compatibility Mode] Microsoft PowerPoint - 07b Ravnoteza para-kapljevina [Compatibility Mode]](/thumbs/99/141228547.jpg) Proračun fazne ravnoteže Predavanja uute za II. numerčk zadatak Proračun fazne ravnoteže roračun vrelšta roračun kaljšta roračun jednokratnog saravanja Proračun vrelšta uz stalnu temeraturu bubble-ont
Proračun fazne ravnoteže Predavanja uute za II. numerčk zadatak Proračun fazne ravnoteže roračun vrelšta roračun kaljšta roračun jednokratnog saravanja Proračun vrelšta uz stalnu temeraturu bubble-ont
SVEUČILIŠTE U ZAGREBU RUDARSKO-GEOLOŠKO-NAFTNI FAKULTET Diplomski studij naftno rudarstvo SIMULACIJA POTROŠNJE ENERGIJE NA NAFTNIM POSTROJENJIMA Diplo
 SVEUČILIŠTE U ZAGREBU RUDARSKO-GEOLOŠKO-NAFTNI FAKULTET Dplomsk studj naftno rudarstvo SIMULACIJA POTROŠNJE ENERGIJE NA NAFTNIM POSTROJENJIMA Dplomsk rad Gojkovć, Vedran N-273 Zagreb, 2018. Sveučlšte u
SVEUČILIŠTE U ZAGREBU RUDARSKO-GEOLOŠKO-NAFTNI FAKULTET Dplomsk studj naftno rudarstvo SIMULACIJA POTROŠNJE ENERGIJE NA NAFTNIM POSTROJENJIMA Dplomsk rad Gojkovć, Vedran N-273 Zagreb, 2018. Sveučlšte u
PLAN I PROGRAM ZA DOPUNSKU (PRODUŽNU) NASTAVU IZ MATEMATIKE (za 1. razred)
 PLAN I PROGRAM ZA DOPUNSKU (PRODUŽNU) NASTAVU IZ MATEMATIKE (za 1. razred) Učenik prvog razreda treba ostvarit sljedeće minimalne standarde 1. SKUP REALNIH BROJEVA -razlikovati brojevne skupove i njihove
PLAN I PROGRAM ZA DOPUNSKU (PRODUŽNU) NASTAVU IZ MATEMATIKE (za 1. razred) Učenik prvog razreda treba ostvarit sljedeće minimalne standarde 1. SKUP REALNIH BROJEVA -razlikovati brojevne skupove i njihove
AV3-OE2-stručni PRIJELAZNE POJAVE Dr.sc. Venco Ćorluka 3. PRIJELAZNE POJAVE 3.1.Prijelazne pojave u mreži s otporom i induktivitetom Serijski spoj otp
 3. PIJAZN POJAV 3.1.Prjelazne pojave u mrež s oporom ndukveom Serjsk spoj opora ndukvea: Naponska jednadžba: ; d u u (3.1) Sruja kroz : 1e (3.) Napon na ndukveu: d u e (3.3) Napon na oporu: u u 1 e nergja
3. PIJAZN POJAV 3.1.Prjelazne pojave u mrež s oporom ndukveom Serjsk spoj opora ndukvea: Naponska jednadžba: ; d u u (3.1) Sruja kroz : 1e (3.) Napon na ndukveu: d u e (3.3) Napon na oporu: u u 1 e nergja
MATEMATIKA viša razina MATA.29.HR.R.K1.24 MAT A D-S MAT A D-S029.indd :30:29
 MATEMATIKA viša razina MAT9.HR.R.K.4.indd 9.9.5. ::9 Prazna stranica 99.indd 9.9.5. ::9 OPĆE UPUTE Pozorno pročitajte sve upute i slijedite ih. Ne okrećite stranicu i ne rješavajte zadatke dok to ne odobri
MATEMATIKA viša razina MAT9.HR.R.K.4.indd 9.9.5. ::9 Prazna stranica 99.indd 9.9.5. ::9 OPĆE UPUTE Pozorno pročitajte sve upute i slijedite ih. Ne okrećite stranicu i ne rješavajte zadatke dok to ne odobri
Elektroenergetski sustav je zajedništvo: generatora, transformatora, vodova i trošila (potrošača)
 SEUČLŠTE U SPLTU Sveučlšn studjsk centar za stručne studje PREDNJ ZŠTT U ELETROENERGETSOM SUSTU Dr. sc. Petar Sarajčev, doc. Robert osor, dpl.ng. Sadržaj SDRŽJ 1. UOD... 1 1.1. ratak osvrt na elektroenergetsk
SEUČLŠTE U SPLTU Sveučlšn studjsk centar za stručne studje PREDNJ ZŠTT U ELETROENERGETSOM SUSTU Dr. sc. Petar Sarajčev, doc. Robert osor, dpl.ng. Sadržaj SDRŽJ 1. UOD... 1 1.1. ratak osvrt na elektroenergetsk
Microsoft Word - Trigonometrijski oblik kompleksnog broja.doc
 Trgonometrjsk oblk kompleksnog broja Da se podsetmo: Kompleksn broj je oblka je realn deo, je magnarn deo kompleksnog broja, - je magnarna jednca, ( Dva kompleksna broja su jednaka ako je Za broj _ je
Trgonometrjsk oblk kompleksnog broja Da se podsetmo: Kompleksn broj je oblka je realn deo, je magnarn deo kompleksnog broja, - je magnarna jednca, ( Dva kompleksna broja su jednaka ako je Za broj _ je
(Microsoft Word - Dr\236avna matura - kolovoz ni\236a razina - rje\232enja)
 1. C. Imamo redom: I. ZADATCI VIŠESTRUKOGA IZBORA. B. Imamo redom: 0.3 0. 8 7 8 19 ( 3) 4 : = 9 4 = 9 4 = 9 = =. 0. 0.3 3 3 3 3 0 1 3 + 1 + 4 8 5 5 = = = = = = 0 1 3 0 1 3 0 1+ 3 ( : ) ( : ) 5 5 4 0 3.
1. C. Imamo redom: I. ZADATCI VIŠESTRUKOGA IZBORA. B. Imamo redom: 0.3 0. 8 7 8 19 ( 3) 4 : = 9 4 = 9 4 = 9 = =. 0. 0.3 3 3 3 3 0 1 3 + 1 + 4 8 5 5 = = = = = = 0 1 3 0 1 3 0 1+ 3 ( : ) ( : ) 5 5 4 0 3.
Microsoft Word - Mat-1---inicijalni testovi--gimnazija
 Inicijalni test BR. 11 za PRVI RAZRED za sve gimnazije i jače tehničke škole 1... Dva radnika okopat će polje za šest dana. Koliko će trebati radnika da se polje okopa za dva dana?? Izračunaj ( ) a) x
Inicijalni test BR. 11 za PRVI RAZRED za sve gimnazije i jače tehničke škole 1... Dva radnika okopat će polje za šest dana. Koliko će trebati radnika da se polje okopa za dva dana?? Izračunaj ( ) a) x
Microsoft Word - predavanje8
 DERIVACIJA KOMPOZICIJE FUNKCIJA Ponekad je potrebno derivirati funkcije koje nisu jednostavne (složene su). Na primjer, funkcija sin2 je kompozicija funkcija sin (vanjska funkcija) i 2 (unutarnja funkcija).
DERIVACIJA KOMPOZICIJE FUNKCIJA Ponekad je potrebno derivirati funkcije koje nisu jednostavne (složene su). Na primjer, funkcija sin2 je kompozicija funkcija sin (vanjska funkcija) i 2 (unutarnja funkcija).
(Microsoft Word - Dr\236avna matura - studeni osnovna razina - rje\232enja)
 1. C. Imamo redom: I. ZADATCI VIŠESTRUKOGA IZBORA 9 + 7 6 9 + 4 51 = = = 5.1 18 4 18 8 10. B. Pomoću kalkulatora nalazimo 10 1.5 = 63.45553. Četvrta decimala je očito jednaka 5, pa se zaokruživanje vrši
1. C. Imamo redom: I. ZADATCI VIŠESTRUKOGA IZBORA 9 + 7 6 9 + 4 51 = = = 5.1 18 4 18 8 10. B. Pomoću kalkulatora nalazimo 10 1.5 = 63.45553. Četvrta decimala je očito jednaka 5, pa se zaokruživanje vrši
Microsoft Word - 12ms121
 Zadatak (Goran, gimnazija) Odredi skup rješenja jednadžbe = Rješenje α = α c osα, a < b < c a + < b + < c +. na segmentu [ ], 6. / = = = supstitucija t = + k, k Z = t = = t t = + k, k Z t = + k. t = +
Zadatak (Goran, gimnazija) Odredi skup rješenja jednadžbe = Rješenje α = α c osα, a < b < c a + < b + < c +. na segmentu [ ], 6. / = = = supstitucija t = + k, k Z = t = = t t = + k, k Z t = + k. t = +
Jednadžbe - ponavljanje
 PRIMJENE NA PRAVOKUTNI TROKUT sin = sin β = cos = cos β = tg kuta tg = tg β = ctg kuta ctg = ctg β = c = p + q Ako su kutovi u trokutu 30 i 60 onda je hipotenuza dva puta veća od kraće katete (c = 2a ili
PRIMJENE NA PRAVOKUTNI TROKUT sin = sin β = cos = cos β = tg kuta tg = tg β = ctg kuta ctg = ctg β = c = p + q Ako su kutovi u trokutu 30 i 60 onda je hipotenuza dva puta veća od kraće katete (c = 2a ili
CRNOGORSKI KOMITET MEĐUNARODNOG VIJEĆA
 CRNOORSKI KOMITET CIRE Mhalo Mcev Elektrotehnĉk fakulet Podgorca mhalo.mcev@gmal.com Vladan Vujĉć Elektrotehnĉk fakulet Podgorca vladanv@ucg.ac.me ESTIMACIJA PARAMETARA NELINEARNO MODELA PREKIDAČKO RELUKTANTNO
CRNOORSKI KOMITET CIRE Mhalo Mcev Elektrotehnĉk fakulet Podgorca mhalo.mcev@gmal.com Vladan Vujĉć Elektrotehnĉk fakulet Podgorca vladanv@ucg.ac.me ESTIMACIJA PARAMETARA NELINEARNO MODELA PREKIDAČKO RELUKTANTNO
Microsoft Word Q19-078
 . Naučno-stručn skup sa međunarodnm učešćem QUALIY 209, Neum, B&H, 4-6 jun 209. SEPENI MODEL REGRESIJE: ODREĐIVANJE KOEFICIJENAA MODELA POWER REGRESSION MODEL: PARAMEERS DEERMINAION Alma Žga, Dr. Sc. Anel
. Naučno-stručn skup sa međunarodnm učešćem QUALIY 209, Neum, B&H, 4-6 jun 209. SEPENI MODEL REGRESIJE: ODREĐIVANJE KOEFICIJENAA MODELA POWER REGRESSION MODEL: PARAMEERS DEERMINAION Alma Žga, Dr. Sc. Anel
(Microsoft Word - Dr\236avna matura - svibanj osnovna razina - rje\232enja)
 I. ZADATCI VIŠESTRUKOGA IZBORA 1. A. Svih pet zadanih razlomaka svedemo na najmanji zajednički nazivnik. Taj nazivnik je najmanji zajednički višekratnik brojeva i 3, tj. NZV(, 3) = 6. Dobijemo: 15 1, 6
I. ZADATCI VIŠESTRUKOGA IZBORA 1. A. Svih pet zadanih razlomaka svedemo na najmanji zajednički nazivnik. Taj nazivnik je najmanji zajednički višekratnik brojeva i 3, tj. NZV(, 3) = 6. Dobijemo: 15 1, 6
Microsoft Word - 6ms001
 Zadatak 001 (Anela, ekonomska škola) Riješi sustav jednadžbi: 5 z = 0 + + z = 14 4 + + z = 16 Rješenje 001 Sustav rješavamo Gaussovom metodom eliminacije (isključivanja). Gaussova metoda provodi se pomoću
Zadatak 001 (Anela, ekonomska škola) Riješi sustav jednadžbi: 5 z = 0 + + z = 14 4 + + z = 16 Rješenje 001 Sustav rješavamo Gaussovom metodom eliminacije (isključivanja). Gaussova metoda provodi se pomoću
MARKOVLJEVI LANCI Prvi kolokvij 28. studenog Zadatak 1. (a) (5 bodova) Za Markovljev lanac (X n ) i njegovo stanje i S neka T (n) i u stanje i.
 Zadatak. (a) (5 bodova) Za Markovljev lanac (X n ) njegovo stanje S neka T (n) u stanje. Dokaºte da za svak n N vrjed P (T (n) < ) = f n, ozna ava n-to vrjeme povratka pr emu je f := P (T () < ). (Napomena:
Zadatak. (a) (5 bodova) Za Markovljev lanac (X n ) njegovo stanje S neka T (n) u stanje. Dokaºte da za svak n N vrjed P (T (n) < ) = f n, ozna ava n-to vrjeme povratka pr emu je f := P (T () < ). (Napomena:
Microsoft Word - 24ms241
 Zadatak (Branko, srednja škola) Parabola zadana jednadžbom = p x prolazi točkom tangente na tu parabolu u točki A? A,. A. x + = 0 B. x 8 = 0 C. x = 0 D. x + + = 0 Rješenje b a b a b a =, =. c c b a Kako
Zadatak (Branko, srednja škola) Parabola zadana jednadžbom = p x prolazi točkom tangente na tu parabolu u točki A? A,. A. x + = 0 B. x 8 = 0 C. x = 0 D. x + + = 0 Rješenje b a b a b a =, =. c c b a Kako
Nastavno pismo 3
 Nastavno pismo Matematika Gimnazija i strukovna škola Jurja Dobrile Pazin Obrazovanje odraslih./. Robert Gortan, pro. Derivacije. Tablica sadržaja 7. DERIVACIJE... 7.. PRAVILA DERIVIRANJA... 7.. TABLICA
Nastavno pismo Matematika Gimnazija i strukovna škola Jurja Dobrile Pazin Obrazovanje odraslih./. Robert Gortan, pro. Derivacije. Tablica sadržaja 7. DERIVACIJE... 7.. PRAVILA DERIVIRANJA... 7.. TABLICA
Microsoft PowerPoint - SamoorganizirajuceNN_2
 Neformaln uvod Samoorganzrajuće neuronske mreže Prof. dr.sc. Bojana Dalbelo-Bašć Marko Čupć, dpl. ng. FER Zagreb Kako uče neuronske mreže? Učenje s učteljem (supervsed learnng) Tpčan prmjer je FF-ANN Backpropagaton
Neformaln uvod Samoorganzrajuće neuronske mreže Prof. dr.sc. Bojana Dalbelo-Bašć Marko Čupć, dpl. ng. FER Zagreb Kako uče neuronske mreže? Učenje s učteljem (supervsed learnng) Tpčan prmjer je FF-ANN Backpropagaton
Sveučilište u Zagrebu
 SVEUČILIŠTE U ZAGREBU FAKULTET ELEKTROTEHNIKE I RAČUNARSTVA SEMINAR Osnovna svojstva kompleksnh mreža njhova prmjena Đan Glavnć 1.02 Vodtelj: Mr.sc. Mle Škć Zagreb, 05, 2007. Sadržaj 1. Uvod...1 2. Uvod
SVEUČILIŠTE U ZAGREBU FAKULTET ELEKTROTEHNIKE I RAČUNARSTVA SEMINAR Osnovna svojstva kompleksnh mreža njhova prmjena Đan Glavnć 1.02 Vodtelj: Mr.sc. Mle Škć Zagreb, 05, 2007. Sadržaj 1. Uvod...1 2. Uvod
(Microsoft Word - Dr\236avna matura - lipanj osnovna razina - rje\232enja)
 1. D. Prirodni brojevi su svi cijeli brojevi strogo veći od nule. je strogo negativan cijeli broj, pa nije prirodan broj. 14 je racionalan broj koji nije cijeli broj. Podijelimo li 14 s 5, dobit ćemo.8,
1. D. Prirodni brojevi su svi cijeli brojevi strogo veći od nule. je strogo negativan cijeli broj, pa nije prirodan broj. 14 je racionalan broj koji nije cijeli broj. Podijelimo li 14 s 5, dobit ćemo.8,
(Microsoft Word - MATB - kolovoz osnovna razina - rje\232enja zadataka)
 . B. Zapišimo zadane brojeve u obliku beskonačno periodičnih decimalnih brojeva: 3 4 = 0.7, = 0.36. Prvi od navedenih četiriju brojeva je manji od 3 4, dok su treći i četvrti veći od. Jedini broj koji
. B. Zapišimo zadane brojeve u obliku beskonačno periodičnih decimalnih brojeva: 3 4 = 0.7, = 0.36. Prvi od navedenih četiriju brojeva je manji od 3 4, dok su treći i četvrti veći od. Jedini broj koji
MAT-KOL (Banja Luka) XXIV (3)(2018), DOI: /МК A ISSN (o) ISSN (o) ZAŠTO K
 AT-KOL (Banja Luka) XXIV ()(018) 147-151 http://wwwmvblrg/dmbl/dmblhtm DOI: 10751/МК180147A ISSN 054-6969 () ISSN 1986-588 () ZAŠTO KOPLIKOVANO KADA OŢE JEDNOSTAVNO Dr Šefket Arslanagć Sarajev 1 Saţetak
AT-KOL (Banja Luka) XXIV ()(018) 147-151 http://wwwmvblrg/dmbl/dmblhtm DOI: 10751/МК180147A ISSN 054-6969 () ISSN 1986-588 () ZAŠTO KOPLIKOVANO KADA OŢE JEDNOSTAVNO Dr Šefket Arslanagć Sarajev 1 Saţetak
Zadaci s rješenjima, a ujedno i s postupkom rada biti će nadopunjavani tokom čitave školske godine
 Zadaci s rješenjima, a ujedno i s postupkom rada biti će nadopunjavani tokom čitave školske godine. Tako da će u slijedećem vremenskom periodu nastati mala zbirka koja će biti popraćena s teorijom. Pošto
Zadaci s rješenjima, a ujedno i s postupkom rada biti će nadopunjavani tokom čitave školske godine. Tako da će u slijedećem vremenskom periodu nastati mala zbirka koja će biti popraćena s teorijom. Pošto
ACTA MATHEMATICA SPALATENSIA Series didactica Vol.2 (2019) O modeliranju standardnih problema poslovne matematike pomoću rekurzija Kristina Mati
 ACTA MATHEMATICA SPALATENSIA Series didactica Vol.2 2019) 23 46 O modeliranju standardnih roblema oslovne matematike omoću rekurzija Kristina Matijević, Bojan Kovačić Sažetak U radu se oisuje matematičko
ACTA MATHEMATICA SPALATENSIA Series didactica Vol.2 2019) 23 46 O modeliranju standardnih roblema oslovne matematike omoću rekurzija Kristina Matijević, Bojan Kovačić Sažetak U radu se oisuje matematičko
Microsoft Word - 15ms261
 Zadatak 6 (Mirko, elektrotehnička škola) Rješenje 6 Odredite sup S, inf S, ma S i min S u skupu R ako je S = { R } a b = a a b + b a b, c < 0 a c b c. ( ), : 5. Skratiti razlomak znači brojnik i nazivnik
Zadatak 6 (Mirko, elektrotehnička škola) Rješenje 6 Odredite sup S, inf S, ma S i min S u skupu R ako je S = { R } a b = a a b + b a b, c < 0 a c b c. ( ), : 5. Skratiti razlomak znači brojnik i nazivnik
Microsoft Word - ETF Journal - Maja
 PERFORMANSE DUAL-DIVERSITY SISTEMA U USLOVIMA KORELISANIH I NEIDENTIČNIH FEDINGA U GRANAMA Maja Ilć-Delbašć, Mlca Pejanovć-Đuršć Ključne rječ: korelacja,ber, dversty Sažetak: U radu su analzrane BER (Bt
PERFORMANSE DUAL-DIVERSITY SISTEMA U USLOVIMA KORELISANIH I NEIDENTIČNIH FEDINGA U GRANAMA Maja Ilć-Delbašć, Mlca Pejanovć-Đuršć Ključne rječ: korelacja,ber, dversty Sažetak: U radu su analzrane BER (Bt
Microsoft Word - Matematika_kozep_irasbeli_javitasi_0611_horvatH.doc
 Matematika horvát nyelven középszint 0611 ÉRETTSÉGI VIZSGA 006. május 9. MATEMATIKA HORVÁT NYELVEN MATEMATIKA KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA PISMENI ISPIT SREDNJEG STUPNJA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ
Matematika horvát nyelven középszint 0611 ÉRETTSÉGI VIZSGA 006. május 9. MATEMATIKA HORVÁT NYELVEN MATEMATIKA KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA PISMENI ISPIT SREDNJEG STUPNJA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ
MAT B MATEMATIKA osnovna razina MATB.38.HR.R.K1.20 MAT B D-S
 MAT B MATEMATIKA osnovna razina MAT38.HR.R.K. Prazna stranica 99 OPĆE UPUTE Pozorno pročitajte sve upute i slijedite ih. Ne okrećite stranicu i ne rješavajte zadatke dok to ne odobri dežurni nastavnik.
MAT B MATEMATIKA osnovna razina MAT38.HR.R.K. Prazna stranica 99 OPĆE UPUTE Pozorno pročitajte sve upute i slijedite ih. Ne okrećite stranicu i ne rješavajte zadatke dok to ne odobri dežurni nastavnik.
1 MATEMATIKA 1 (prva zadaća) Vektori i primjene 1. U trokutu ABC točke M i N dijele stranicu AB na tri jednaka dijela. O
 http://www.fsb.hr/matematika/ (prva zadać Vektori i primjene. U trokutu ABC točke M i N dijele stranicu AB na tri jednaka dijela. Označite CA= a, CB= b i izrazite vektore CM i CN pomoću vektora a i b..
http://www.fsb.hr/matematika/ (prva zadać Vektori i primjene. U trokutu ABC točke M i N dijele stranicu AB na tri jednaka dijela. Označite CA= a, CB= b i izrazite vektore CM i CN pomoću vektora a i b..
(Microsoft Word - Dr\236avna matura - kolovoz osnovna razina - rje\232enja)
 I. ZADATCI VIŠESTRUKOGA IZBORA. C. Zadani broj očito nije niti prirodan broj niti cijeli broj. Budući da je 3 78 3. = =, 00 5 zadani broj možemo zapisati u obliku razlomka kojemu je brojnik cijeli broj
I. ZADATCI VIŠESTRUKOGA IZBORA. C. Zadani broj očito nije niti prirodan broj niti cijeli broj. Budući da je 3 78 3. = =, 00 5 zadani broj možemo zapisati u obliku razlomka kojemu je brojnik cijeli broj
(Microsoft Word - Rje\232enja zadataka)
 1. D. Svedimo sve razlomke na jedinstveni zajednički nazivnik. Lako provjeravamo da vrijede rastavi: 85 = 17 5, 187 = 17 11, 170 = 17 10, pa je zajednički nazivnik svih razlomaka jednak Tako sada imamo:
1. D. Svedimo sve razlomke na jedinstveni zajednički nazivnik. Lako provjeravamo da vrijede rastavi: 85 = 17 5, 187 = 17 11, 170 = 17 10, pa je zajednički nazivnik svih razlomaka jednak Tako sada imamo:
(Microsoft Word - Dr\236avna matura - lipanj osnovna razina - rje\232enja)
 1. C. Interval, tvore svi realni brojevi strogo manji od. Interval, 9] tvore svi realni brojevi strogo veći od i jednaki ili manji od 9. Interval [1, 8] tvore svi realni brojevi jednaki ili veći od 1,
1. C. Interval, tvore svi realni brojevi strogo manji od. Interval, 9] tvore svi realni brojevi strogo veći od i jednaki ili manji od 9. Interval [1, 8] tvore svi realni brojevi jednaki ili veći od 1,
Planovi prijema za numeričke karakteristike kvaliteta
 U N I V E Z I T E T U B E O G A D U F A K U L T E T O G A N I Z A C I O N I H N A U K A Kontrola valteta (osnovne aademse studje) Stablnost procesa numerče ontrolne arte 1. U određenm vremensm ntervalma
U N I V E Z I T E T U B E O G A D U F A K U L T E T O G A N I Z A C I O N I H N A U K A Kontrola valteta (osnovne aademse studje) Stablnost procesa numerče ontrolne arte 1. U određenm vremensm ntervalma
(Microsoft Word - Dr\236avna matura - rujan osnovna razina - rje\232enja)
 I. ZADATCI VIŠESTRUKOGA IZBORA. B. Broj je cijeli broj, tj. pripada skupu cijelih brojeva Z. Skup cijelih brojeva Z je pravi podskup skupa racionalnih brojeva Q, pa je i racionalan broj. 9 4 je očito broj
I. ZADATCI VIŠESTRUKOGA IZBORA. B. Broj je cijeli broj, tj. pripada skupu cijelih brojeva Z. Skup cijelih brojeva Z je pravi podskup skupa racionalnih brojeva Q, pa je i racionalan broj. 9 4 je očito broj
(Microsoft Word doma\346a zada\346a)
 1. Napišite (u sva tri oblika: eksplicitnom, implicitnom i segmentnom) jednadžbu tangente i jednadžbu normale povučene na graf funkcije f u točki T, te izračunajte njihove duljine (s točnošću od 10 5 )
1. Napišite (u sva tri oblika: eksplicitnom, implicitnom i segmentnom) jednadžbu tangente i jednadžbu normale povučene na graf funkcije f u točki T, te izračunajte njihove duljine (s točnošću od 10 5 )
IZBORNO NATJECANJE ZA IMC - RJEŠENJA Zadatak 1. Odredite sve polinome f i g s realnim koeficijentima koji zadovoljavaju jednakost (f(x))
 IZBORNO NATJECANJE ZA IMC - RJEŠENJA 7. 06. 017. Zadata 1. Odredte sve polnome f g s realnm oefcjentma oj zadovoljavaju jednaost (f(x)) 3 (g(x)) = 1, x R. Rješenje. Pretpostavmo da je deg f = n > 0, tada
IZBORNO NATJECANJE ZA IMC - RJEŠENJA 7. 06. 017. Zadata 1. Odredte sve polnome f g s realnm oefcjentma oj zadovoljavaju jednaost (f(x)) 3 (g(x)) = 1, x R. Rješenje. Pretpostavmo da je deg f = n > 0, tada
PowerPoint-Präsentation
 Nivo zvuka zašto? () Efekat Odnos intenzita zvuka (refernentna vrednost) ntenzitet zvuka [W/m ] Tiični izvor zvuka Dinamički oseg čujnosti uva: - W/m W/m. - - zražavanje veličina intenziteta zvuka sistemom
Nivo zvuka zašto? () Efekat Odnos intenzita zvuka (refernentna vrednost) ntenzitet zvuka [W/m ] Tiični izvor zvuka Dinamički oseg čujnosti uva: - W/m W/m. - - zražavanje veličina intenziteta zvuka sistemom
SVEUČILIŠTE U ZAGREBU
 SVEUČILIŠTE U ZAGREBU FAKULTET KEMIJSKOG INŽENJERSTVA I TEHNOLOGIJE SVEUČILIŠNI STUDIJ KEMIJSKOG INŽENJERSTVA I TEHNOLOGIJE TOMISLAV KARAŽIJA D I P L O M S K I R A D Zagreb, lpanj 2008. SVEUČILIŠTE U ZAGREBU
SVEUČILIŠTE U ZAGREBU FAKULTET KEMIJSKOG INŽENJERSTVA I TEHNOLOGIJE SVEUČILIŠNI STUDIJ KEMIJSKOG INŽENJERSTVA I TEHNOLOGIJE TOMISLAV KARAŽIJA D I P L O M S K I R A D Zagreb, lpanj 2008. SVEUČILIŠTE U ZAGREBU
(Microsoft Word - Dr\236avna matura - svibanj vi\232a razina - rje\232enja)
 I. ZADATCI VIŠESTRUKOGA IZBORA. D. Skup svih realnih brojeva koji su jednaki ili manji od je interval, ]. Skup svih realnih brojeva koji su strogo veći od je interval, +. Traženi skup tvore svi realni
I. ZADATCI VIŠESTRUKOGA IZBORA. D. Skup svih realnih brojeva koji su jednaki ili manji od je interval, ]. Skup svih realnih brojeva koji su strogo veći od je interval, +. Traženi skup tvore svi realni
ŽUPANIJSKO NATJECANJE IZ MATEMATIKE 28. veljače razred - rješenja OVDJE SU DANI NEKI NAČINI RJEŠAVANJA ZADATAKA. UKOLIKO UČENIK IMA DRUGAČIJI
 ŽUANIJSKO NATJECANJE IZ MATEMATIKE 8. veljače 09. 8. razred - rješenja OVDJE SU DANI NEKI NAČINI RJEŠAVANJA ZADATAKA. UKOLIKO UČENIK IMA DRUGAČIJI OSTUAK RJEŠAVANJA, ČLAN OVJERENSTVA DUŽAN JE I TAJ OSTUAK
ŽUANIJSKO NATJECANJE IZ MATEMATIKE 8. veljače 09. 8. razred - rješenja OVDJE SU DANI NEKI NAČINI RJEŠAVANJA ZADATAKA. UKOLIKO UČENIK IMA DRUGAČIJI OSTUAK RJEŠAVANJA, ČLAN OVJERENSTVA DUŽAN JE I TAJ OSTUAK
Numeričke metode u fizici 1, Projektni zadataci 2018./ Za sustav običnih diferencijalnih jednadžbi, koje opisuju kretanje populacije dviju vrs
 Numeričke metode u fizici, Projektni zadataci 8./9.. Za sustav običnih diferencijalnih jednadžbi, koje opisuju kretanje populacije dviju vrsta životinja koje se nadmeću za istu hranu, dx ( dt = x x ) xy
Numeričke metode u fizici, Projektni zadataci 8./9.. Za sustav običnih diferencijalnih jednadžbi, koje opisuju kretanje populacije dviju vrsta životinja koje se nadmeću za istu hranu, dx ( dt = x x ) xy
Microsoft Word - STO_VALJA_ZAPAMTITI_11.doc
 EHANIKA FLUIDA I Što valja zapamtt 40 Zaon očuvanja momenta olčne gbanja Dencja zaona očuvanja momenta olčne gbanja za materjaln volumen: Brzna promjene momenta olčne gbanja materjalnog volumena jednaa
EHANIKA FLUIDA I Što valja zapamtt 40 Zaon očuvanja momenta olčne gbanja Dencja zaona očuvanja momenta olčne gbanja za materjaln volumen: Brzna promjene momenta olčne gbanja materjalnog volumena jednaa
(Microsoft Word - Dr\236avna matura - lipanj osnovna razina - rje\232enja)
 1. C. Zaokružimo li zadani broj na najbliži cijeli broj, dobit ćemo 5 (jer je prva znamenka iza decimalne točke 5). Zaokružimo li zadani broj na jednu decimalu, dobit ćemo 4.6 jer je druga znamenka iza
1. C. Zaokružimo li zadani broj na najbliži cijeli broj, dobit ćemo 5 (jer je prva znamenka iza decimalne točke 5). Zaokružimo li zadani broj na jednu decimalu, dobit ćemo 4.6 jer je druga znamenka iza
Microsoft Word - Molekuli-zadaci.doc
 Задаци Други колоквијум - Молекулски спектри Пример 1 Израчунајте апсорбанцију раствора, ако је познато да је транспаренција 89% на 00 nm. А 0,071 λ 00 nm таласна дужина на којој је мерена апсорбанција
Задаци Други колоквијум - Молекулски спектри Пример 1 Израчунајте апсорбанцију раствора, ако је познато да је транспаренција 89% на 00 nm. А 0,071 λ 00 nm таласна дужина на којој је мерена апсорбанција
BS-predavanje-3-plinovi-krutine-tekucine
 STRUKTURA ČISTIH TVARI Pojam temperature Porastom temperature raste brzina gibanja plina, osciliranje atoma i molekula u kristalu i tekućini Temperatura izražava intenzivnost gibanja atoma i molekula u
STRUKTURA ČISTIH TVARI Pojam temperature Porastom temperature raste brzina gibanja plina, osciliranje atoma i molekula u kristalu i tekućini Temperatura izražava intenzivnost gibanja atoma i molekula u
Skalarne funkcije više varijabli Parcijalne derivacije Skalarne funkcije više varijabli i parcijalne derivacije Franka Miriam Brückler
 i parcijalne derivacije Franka Miriam Brückler Jednadžba stanja idealnog plina uz p = nrt V f (x, y, z) = xy z x = n mol, y = T K, z = V L, f == p Pa. Pritom je kodomena od f skup R, a domena je Jednadžba
i parcijalne derivacije Franka Miriam Brückler Jednadžba stanja idealnog plina uz p = nrt V f (x, y, z) = xy z x = n mol, y = T K, z = V L, f == p Pa. Pritom je kodomena od f skup R, a domena je Jednadžba
os07zup-rjes.dvi
 RJEŠENJA ZA 4. RAZRED OVDJE JE DAN JEDAN NAČIN RJEŠAVANJA ZADATAKA. UKOLIKO UČENIK IMA DRUGA- ČIJI POSTUPAK RJEŠAVANJA, ČLAN POVJERENSTVA DUŽAN JE I TAJ POSTUPAK OCI- JENITI I BODOVATI NA ODGOVARAJUĆI
RJEŠENJA ZA 4. RAZRED OVDJE JE DAN JEDAN NAČIN RJEŠAVANJA ZADATAKA. UKOLIKO UČENIK IMA DRUGA- ČIJI POSTUPAK RJEŠAVANJA, ČLAN POVJERENSTVA DUŽAN JE I TAJ POSTUPAK OCI- JENITI I BODOVATI NA ODGOVARAJUĆI
PARCIJALNO MOLARNE VELIČINE
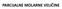 PARCIJALNE MOLARNE VELIČINE ZATVOREN TERMODINAMIČKI SISTEM-konstantan sastav sistema Posmatra se neka termodinamička ekstenzivna veličina X X (V, U, H, G, A, S) X je u funkciji bilo kog para intenzivnih
PARCIJALNE MOLARNE VELIČINE ZATVOREN TERMODINAMIČKI SISTEM-konstantan sastav sistema Posmatra se neka termodinamička ekstenzivna veličina X X (V, U, H, G, A, S) X je u funkciji bilo kog para intenzivnih
Microsoft Word - Kruno Kantoci-NDU.doc
 Zavod za robotku automatzacju prozvodnh sustava Katedra za strojarsku automatku Semnarsk rad z kolegja NEZRAZTO DGTALNO UPRAVLJANJE Snteza P regulatora estmatora varjabl stanja elektromotornog pogona s
Zavod za robotku automatzacju prozvodnh sustava Katedra za strojarsku automatku Semnarsk rad z kolegja NEZRAZTO DGTALNO UPRAVLJANJE Snteza P regulatora estmatora varjabl stanja elektromotornog pogona s
Hej hej bojiš se matematike? Ma nema potrebe! Dobra priprema je pola obavljenog posla, a da bi bio izvrsno pripremljen tu uskačemo mi iz Štreberaja. D
 Hej hej bojiš se matematike? Ma nema potrebe! Dobra priprema je pola obavljenog posla, a da bi bio izvrsno pripremljen tu uskačemo mi iz Štreberaja. Donosimo ti primjere ispita iz matematike, s rješenjima.
Hej hej bojiš se matematike? Ma nema potrebe! Dobra priprema je pola obavljenog posla, a da bi bio izvrsno pripremljen tu uskačemo mi iz Štreberaja. Donosimo ti primjere ispita iz matematike, s rješenjima.
Microsoft Word - 24ms221
 Zadatak (Katarina, maturantica) Kružnica dira os apscisa u točki (3, 0) i siječe os ordinata u točki (0, 0). Koliki je polumjer te kružnice? A. 5 B. 5.45 C. 6.5. 7.38 Rješenje Kružnica je skup svih točaka
Zadatak (Katarina, maturantica) Kružnica dira os apscisa u točki (3, 0) i siječe os ordinata u točki (0, 0). Koliki je polumjer te kružnice? A. 5 B. 5.45 C. 6.5. 7.38 Rješenje Kružnica je skup svih točaka
8. razred kriteriji pravi
 KRITERIJI OCJENJIVANJA MATEMATIKA 8. RAZRED Učenik će iz nastavnog predmeta matematike biti ocjenjivan usmeno i pismeno. Pismeno ocjenjivanje: U osmom razredu piše se šest ispita znanja i bodovni prag
KRITERIJI OCJENJIVANJA MATEMATIKA 8. RAZRED Učenik će iz nastavnog predmeta matematike biti ocjenjivan usmeno i pismeno. Pismeno ocjenjivanje: U osmom razredu piše se šest ispita znanja i bodovni prag
GEOMETRIJSKE KARAKTERISTIKE PRESEKA POPREČNOG PRESEKA GREDE PRIMERI
 OM V9 V0 me reme: ndex br: 8.6. EKSCENTRČNO NPREZNJE GREDE EKSCENTRČNO NPREZNJE GREDE PRMER PRMER. Za reseke rkaane na skc, nacrtat jegro reseka. ravougaon resek kružn resek OM V9 V0 me reme: ndex br:
OM V9 V0 me reme: ndex br: 8.6. EKSCENTRČNO NPREZNJE GREDE EKSCENTRČNO NPREZNJE GREDE PRMER PRMER. Za reseke rkaane na skc, nacrtat jegro reseka. ravougaon resek kružn resek OM V9 V0 me reme: ndex br:
OKFH2-12
 ELEKTRIČNE OSOBINE Električne osobine atoma i molekula uslovljavaju: ojavu dvojnog relamanja svetlosti ojavu olarizacije rasejane svetlosti dielektrične osobine međumolekulske interakcije ravila izbora
ELEKTRIČNE OSOBINE Električne osobine atoma i molekula uslovljavaju: ojavu dvojnog relamanja svetlosti ojavu olarizacije rasejane svetlosti dielektrične osobine međumolekulske interakcije ravila izbora
JMBAG IME I PREZIME BROJ BODOVA 1. (ukupno 20 bodova) MJERA I INTEGRAL Popravni ispit 7. rujna (Knjige, bilježnice, dodatni papiri i kalkulatori
 1. (ukuno 20 bodova) MJERA I INTEGRAL Poravni isit 7. rujna 2018. (Knjige, bilježnice, dodatni airi i kalkulatori nisu dozvoljeni!) (a) (4 boda) Neka je nerazan sku. Precizno definirajte ojam σ-rstena
1. (ukuno 20 bodova) MJERA I INTEGRAL Poravni isit 7. rujna 2018. (Knjige, bilježnice, dodatni airi i kalkulatori nisu dozvoljeni!) (a) (4 boda) Neka je nerazan sku. Precizno definirajte ojam σ-rstena
Microsoft Word - z4Ž2018a
 4. razred - osnovna škola 1. Izračunaj: 52328 28 : 2 + (8 5320 + 5320 2) + 4827 5 (145 145) 2. Pomoću 5 kružića prikazano je tijelo gusjenice. Gusjenicu treba obojiti tako da dva kružića budu crvene boje,
4. razred - osnovna škola 1. Izračunaj: 52328 28 : 2 + (8 5320 + 5320 2) + 4827 5 (145 145) 2. Pomoću 5 kružića prikazano je tijelo gusjenice. Gusjenicu treba obojiti tako da dva kružića budu crvene boje,
Microsoft Word - 12ms101
 Zadatak 0 (Sanela, Anamarija, maturantice gimnazije) Riješi jednadžbu: = Rješenje 0 α = α α / = = = supstitucija t = + k, k Z = t = = t t = + k, k Z t = + k t = + k Vraćamo se supstituciji: t = + k = +
Zadatak 0 (Sanela, Anamarija, maturantice gimnazije) Riješi jednadžbu: = Rješenje 0 α = α α / = = = supstitucija t = + k, k Z = t = = t t = + k, k Z t = + k t = + k Vraćamo se supstituciji: t = + k = +
18 1 DERIVACIJA 1.3 Derivacije višeg reda n-tu derivaciju funkcije f označavamo s f (n) ili u Leibnizovoj notaciji s dn y d x n. Zadatak 1.22 Nadite f
 8 DERIVACIJA.3 Derivacije višeg reda n-tu derivaciju funcije f označavamo s f (n) ili u Leibnizovoj notaciji s dn y d x n. Zadata. Nadite f (x) ao je (a) f(x) = ( + x ) arctg x (b) f(x) = e x cos x (a)
8 DERIVACIJA.3 Derivacije višeg reda n-tu derivaciju funcije f označavamo s f (n) ili u Leibnizovoj notaciji s dn y d x n. Zadata. Nadite f (x) ao je (a) f(x) = ( + x ) arctg x (b) f(x) = e x cos x (a)
(Microsoft Word - Dr\236avna matura - svibanj vi\232a razina - rje\232enja)
 . D. Podijelimo zadanu jednakost s R T, pa dobijemo. D. Pomnožimo zadanu nejednakost sa 6. Dobivamo: p V n =. R T < x < 5. Ovu nejednakost zadovoljavaju cijeli brojevi, 0,,, i 4. i su suprotni brojevi
. D. Podijelimo zadanu jednakost s R T, pa dobijemo. D. Pomnožimo zadanu nejednakost sa 6. Dobivamo: p V n =. R T < x < 5. Ovu nejednakost zadovoljavaju cijeli brojevi, 0,,, i 4. i su suprotni brojevi
Elementi praćenja i ocjenjivanja za nastavni predmet Matematika u 4. razredu Elementi praćenja i ocjenjivanja za nastavni predmet Matematika u 4. razr
 Elementi praćenja i ocjenjivanja za nastavni predmet Matematika u 4. razredu ODLIČAN (5) navodi primjer kuta kao dijela ravnine omeđenog polupravcima analizira i uspoređuje vrh i krakove kuta analizira
Elementi praćenja i ocjenjivanja za nastavni predmet Matematika u 4. razredu ODLIČAN (5) navodi primjer kuta kao dijela ravnine omeđenog polupravcima analizira i uspoređuje vrh i krakove kuta analizira
Matrice. Algebarske operacije s matricama. - Predavanje I
 Matrice.. Predavanje I Ines Radošević inesr@math.uniri.hr Odjel za matematiku Sveučilišta u Rijeci Matrice... Matrice... Podsjeti se... skup, element skupa,..., matematička logika skupovi brojeva N,...,
Matrice.. Predavanje I Ines Radošević inesr@math.uniri.hr Odjel za matematiku Sveučilišta u Rijeci Matrice... Matrice... Podsjeti se... skup, element skupa,..., matematička logika skupovi brojeva N,...,
Matematika 1 - izborna
 3.3. NELINEARNE DIOFANTSKE JEDNADŽBE Navest ćemo sada neke metode rješavanja diofantskih jednadžbi koje su drugog i viših stupnjeva. Sve su te metode zapravo posebni oblici jedne opće metode, koja se naziva
3.3. NELINEARNE DIOFANTSKE JEDNADŽBE Navest ćemo sada neke metode rješavanja diofantskih jednadžbi koje su drugog i viših stupnjeva. Sve su te metode zapravo posebni oblici jedne opće metode, koja se naziva
Sveučilište u Splitu Fakultet prirodoslovno-matematičkih znanosti i odgojnih područja Zavod za fiziku Pripremni tečaj za studente prve godine INTEGRAL
 Sveučilište u Splitu Fakultet prirodoslovno-matematičkih znanosti i odgojnih područja Zavod za fiziku Pripremni tečaj za studente prve godine INTEGRALI Sastavio: Ante Bilušić Split, rujan 4. 1 Neodredeni
Sveučilište u Splitu Fakultet prirodoslovno-matematičkih znanosti i odgojnih područja Zavod za fiziku Pripremni tečaj za studente prve godine INTEGRALI Sastavio: Ante Bilušić Split, rujan 4. 1 Neodredeni
1. KOLOKVIJ IZ MATEMATIKE I, PRVI DIO - GRUPA A 24. listopada (i) Napi²ite formulu za determinantu i inverz op e matrice drugog reda, te nave
 1 KOLOKVIJ IZ MATEMATIKE I, PRVI DIO - GRUPA A 4 lstopada 011 1 () Nap²te formulu a determnantu nver op e matrce drugog reda, te navedte uvjet ( ) 3 7 1 11 1 3 () Provjerte je l matrca B = 1 3 1 5 nverna
1 KOLOKVIJ IZ MATEMATIKE I, PRVI DIO - GRUPA A 4 lstopada 011 1 () Nap²te formulu a determnantu nver op e matrce drugog reda, te navedte uvjet ( ) 3 7 1 11 1 3 () Provjerte je l matrca B = 1 3 1 5 nverna
ЗАДАЦИ ИЗ МАТЕМАТИКЕ ЗА ПРИПРЕМАЊЕ ЗАВРШНОГ ИСПИТА
 ЗАДАЦИ ИЗ МАТЕМАТИКЕ ЗА ПРИПРЕМАЊЕ ЗАВРШНОГ ИСПИТА p m m m Дат је полином ) Oдредити параметар m тако да полином p буде дељив са б) Одредити параметар m тако да остатак при дељењу p са буде једнак 7 а)
ЗАДАЦИ ИЗ МАТЕМАТИКЕ ЗА ПРИПРЕМАЊЕ ЗАВРШНОГ ИСПИТА p m m m Дат је полином ) Oдредити параметар m тако да полином p буде дељив са б) Одредити параметар m тако да остатак при дељењу p са буде једнак 7 а)
Matematika_kozep_irasbeli_javitasi_1013_horvat
 Matematika horvát nyelven középszint 1013 ÉRETTSÉGI VIZSGA 013. május 7. MATEMATIKA HORVÁT NYELVEN KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Formalni
Matematika horvát nyelven középszint 1013 ÉRETTSÉGI VIZSGA 013. május 7. MATEMATIKA HORVÁT NYELVEN KÖZÉPSZINTŰ ÍRÁSBELI ÉRETTSÉGI VIZSGA JAVÍTÁSI-ÉRTÉKELÉSI ÚTMUTATÓ EMBERI ERŐFORRÁSOK MINISZTÉRIUMA Formalni
Državna matura iz informatike
 DRŽAVNA MATURA IZ INFORMATIKE U ŠK. GOD. 2013./14. 2016./17. SADRŽAJ Osnovne informacije o ispitu iz informatike Područja ispitivanja Pragovi prolaznosti u 2014./15. Primjeri zadataka po područjima ispitivanja
DRŽAVNA MATURA IZ INFORMATIKE U ŠK. GOD. 2013./14. 2016./17. SADRŽAJ Osnovne informacije o ispitu iz informatike Područja ispitivanja Pragovi prolaznosti u 2014./15. Primjeri zadataka po područjima ispitivanja
SVEUČILIŠTE U ZAGREBU RUDARSKO-GEOLOŠKO-NAFTNI FAKULTET Diplomski studij naftnog rudarstva PRIMJENA KUBIČNE JEDNADŽBE STANJA NA PROŠIRENI OPIS PVT SVO
 SVEUČILIŠTE U ZAGREBU RUDARSKO-GEOLOŠKO-NAFTNI FAKULTET Diplomski studij naftnog rudarstva PRIMJENA KUBIČNE JEDNADŽBE STANJA NA PROŠIRENI OPIS PVT SVOJSTAVA FLUIDA Diplomski rad Valentino Petrović N-226
SVEUČILIŠTE U ZAGREBU RUDARSKO-GEOLOŠKO-NAFTNI FAKULTET Diplomski studij naftnog rudarstva PRIMJENA KUBIČNE JEDNADŽBE STANJA NA PROŠIRENI OPIS PVT SVOJSTAVA FLUIDA Diplomski rad Valentino Petrović N-226
(Microsoft Word - Dr\236avna matura - lipanj vi\232a razina - rje\232enja)
 C Vrijedi jednakost: = 075, pa zaključujemo da vrijedi nejednakost 4 To znači da zadani broj pripada intervalu, 05 < < 05 4 D Riješimo zadanu jednadžbu na uobičajen način: x 7 x + = 0, x, 7 ± ( 7) 4 7
C Vrijedi jednakost: = 075, pa zaključujemo da vrijedi nejednakost 4 To znači da zadani broj pripada intervalu, 05 < < 05 4 D Riješimo zadanu jednadžbu na uobičajen način: x 7 x + = 0, x, 7 ± ( 7) 4 7
Microsoft Word - Rijeseni primjeri 15 vjezbe iz Mehanike fluida I.doc
 . Odredite ubitke tlaka pri strujanju zraka (ρ=,5 k/m 3 =konst., ν =,467-5 m /s) protokom =5 m 3 /s kroz cjevovod duljine L=6 m pravokutno presjeka axb=6x3 mm. Cijev je od alvanizirano željeza. Rješenje:
. Odredite ubitke tlaka pri strujanju zraka (ρ=,5 k/m 3 =konst., ν =,467-5 m /s) protokom =5 m 3 /s kroz cjevovod duljine L=6 m pravokutno presjeka axb=6x3 mm. Cijev je od alvanizirano željeza. Rješenje:
EUROPSKA KOMISIJA Bruxelles, C(2019) 1710 final ANNEX PRILOG DELEGIRANOJ UREDBI KOMISIJE (EU) /.. o izmjeni priloga I. i II. Uredbi (EU) br.
 EUROPSKA KOMISIJA Bruxelles, 7.3.2019. C(2019) 1710 final ANNEX PRILOG DELEGIRANOJ UREDBI KOMISIJE (EU) /.. o izmjeni priloga I. i II. Uredbi (EU) br. 510/2011 Europskog parlamenta i Vijeća u pogledu praćenja
EUROPSKA KOMISIJA Bruxelles, 7.3.2019. C(2019) 1710 final ANNEX PRILOG DELEGIRANOJ UREDBI KOMISIJE (EU) /.. o izmjeni priloga I. i II. Uredbi (EU) br. 510/2011 Europskog parlamenta i Vijeća u pogledu praćenja
Natjecanje 2016.
 I RAZRED Zadatak 1 Grafiĉki predstavi funkciju RJEŠENJE 2, { Za, imamo Za, ), imamo, Za imamo I RAZRED Zadatak 2 Neka su realni brojevi koji nisu svi jednaki, takvi da vrijedi Dokaži da je RJEŠENJE Neka
I RAZRED Zadatak 1 Grafiĉki predstavi funkciju RJEŠENJE 2, { Za, imamo Za, ), imamo, Za imamo I RAZRED Zadatak 2 Neka su realni brojevi koji nisu svi jednaki, takvi da vrijedi Dokaži da je RJEŠENJE Neka
(Microsoft Word - Dr\236avna matura - kolovoz osnovna razina - rje\232enja)
 5 5: 5 5. B. Broj.5 možemo zapisati u obliku = =, a taj broj nije cijeli broj. 0 0 : 5 Broj 5 je iracionalan broj, pa taj broj nije cijeli broj. Broj 5 je racionalan broj koji nije cijeli broj jer broj
5 5: 5 5. B. Broj.5 možemo zapisati u obliku = =, a taj broj nije cijeli broj. 0 0 : 5 Broj 5 je iracionalan broj, pa taj broj nije cijeli broj. Broj 5 je racionalan broj koji nije cijeli broj jer broj
1 Konusni preseci (drugim rečima: kružnica, elipsa, hiperbola i parabola) Definicija 0.1 Algebarska kriva drugog reda u ravni jeste skup tačaka opisan
 1 Konusni preseci (drugim rečima: kružnica, elipsa, hiperbola i parabola) Definicija 0.1 Algebarska kriva drugog reda u ravni jeste skup tačaka opisan jednačinom oblika: a 11 x 2 + 2a 12 xy + a 22 y 2
1 Konusni preseci (drugim rečima: kružnica, elipsa, hiperbola i parabola) Definicija 0.1 Algebarska kriva drugog reda u ravni jeste skup tačaka opisan jednačinom oblika: a 11 x 2 + 2a 12 xy + a 22 y 2
IZVORNI ZNANSTVENI RAD SIGURNOST 55 (1) 9-17 (2013) V. Vađić, S. Žužul, J. Rinkovec, G. Pehnec* METALI U SITNIM ČESTICAMA U ZRAKU ZAGREBA UDK 546.4/.6
 IZVORNI ZNANSTVENI RAD V. Vađć, S. Žužul, J. Rnkovec, G. Pehnec* METALI U SITNIM ČESTICAMA U ZRAKU ZAGREBA UDK 546.4/.6:504.3.054](497.5-25) PRIMLJENO: 18.5.2012. PRIHVAĆENO: 2.10.2012. SAŽETAK: S praćenjem
IZVORNI ZNANSTVENI RAD V. Vađć, S. Žužul, J. Rnkovec, G. Pehnec* METALI U SITNIM ČESTICAMA U ZRAKU ZAGREBA UDK 546.4/.6:504.3.054](497.5-25) PRIMLJENO: 18.5.2012. PRIHVAĆENO: 2.10.2012. SAŽETAK: S praćenjem
Microsoft Word - V03-Prelijevanje.doc
 Praktikum iz hidraulike Str. 3-1 III vježba Prelijevanje preko širokog praga i preljeva praktičnog profila Mali stakleni žlijeb je izrađen za potrebe mjerenja pojedinih hidrauličkih parametara tečenja
Praktikum iz hidraulike Str. 3-1 III vježba Prelijevanje preko širokog praga i preljeva praktičnog profila Mali stakleni žlijeb je izrađen za potrebe mjerenja pojedinih hidrauličkih parametara tečenja
JMBAG IME I PREZIME BROJ BODOVA 1. (ukupno 6 bodova) MJERA I INTEGRAL 1. kolokvij 4. svibnja (Knjige, bilježnice, dodatni papiri i kalkulatori n
 1. (ukupno 6 bodova) MJERA I INTEGRAL 1. kolokvij 4. svibnja 2018. (Knjige, bilježnice, dodatni papiri i kalkulatori nisu dozvoljeni!) (a) (2 boda) Definirajte (općenitu) vanjsku mjeru. (b) (2 boda) Definirajte
1. (ukupno 6 bodova) MJERA I INTEGRAL 1. kolokvij 4. svibnja 2018. (Knjige, bilježnice, dodatni papiri i kalkulatori nisu dozvoljeni!) (a) (2 boda) Definirajte (općenitu) vanjsku mjeru. (b) (2 boda) Definirajte
Matematka 1 Zadaci za vežbe Oktobar Uvod 1.1. Izračunati vrednost izraza (bez upotrebe pomoćnih sredstava): ( ) [ a) : b) 3 3
 Matematka Zadaci za vežbe Oktobar 5 Uvod.. Izračunati vrednost izraza bez upotrebe pomoćnih sredstava): ) [ a) 98.8.6 : b) : 7 5.5 : 8 : ) : :.. Uprostiti izraze: a) b) ) a b a+b + 6b a 9b + y+z c) a +b
Matematka Zadaci za vežbe Oktobar 5 Uvod.. Izračunati vrednost izraza bez upotrebe pomoćnih sredstava): ) [ a) 98.8.6 : b) : 7 5.5 : 8 : ) : :.. Uprostiti izraze: a) b) ) a b a+b + 6b a 9b + y+z c) a +b
Newtonova metoda za rješavanje nelinearne jednadžbe f(x)=0
 za rješavanje nelinearne jednadžbe f (x) = 0 Ime Prezime 1, Ime Prezime 2 Odjel za matematiku Sveučilište u Osijeku Seminarski rad iz Matematičkog praktikuma Ime Prezime 1, Ime Prezime 2 za rješavanje
za rješavanje nelinearne jednadžbe f (x) = 0 Ime Prezime 1, Ime Prezime 2 Odjel za matematiku Sveučilište u Osijeku Seminarski rad iz Matematičkog praktikuma Ime Prezime 1, Ime Prezime 2 za rješavanje
Microsoft Word - Rjesenja zadataka
 1. C. Svi elementi zadanoga intervala su realni brojevi strogo veći od 4 i strogo manji od. Brojevi i 5 nisu strogo veći od 4, a 1 nije strogo manji od. Jedino je broj 3 strogo veći od 4 i strogo manji
1. C. Svi elementi zadanoga intervala su realni brojevi strogo veći od 4 i strogo manji od. Brojevi i 5 nisu strogo veći od 4, a 1 nije strogo manji od. Jedino je broj 3 strogo veći od 4 i strogo manji
Elementarna matematika 1 - Oblici matematickog mišljenja
 Oblici matematičkog mišljenja 2007/2008 Mišljenje (psihološka definicija) = izdvajanje u čovjekovoj spoznaji odre denih strana i svojstava promatranog objekta i njihovo dovo denje u odgovarajuće veze s
Oblici matematičkog mišljenja 2007/2008 Mišljenje (psihološka definicija) = izdvajanje u čovjekovoj spoznaji odre denih strana i svojstava promatranog objekta i njihovo dovo denje u odgovarajuće veze s
MAT-KOL (Banja Luka) ISSN (p), ISSN (o) Vol. XVIII (1)(2012), Interesantna primjena Mellinove transformacije Samra Pirić 1,
 MAT-KOL (Banja Luka ISSN 0354-6969 (, ISSN 986-58 (o Vol. XVIII ((0, 7-3 Interesantna rimjena Mellinove transformacije Samra Pirić, Sanela Halilović Sažetak. U radu je okazano kako Mellinova transformacija
MAT-KOL (Banja Luka ISSN 0354-6969 (, ISSN 986-58 (o Vol. XVIII ((0, 7-3 Interesantna rimjena Mellinove transformacije Samra Pirić, Sanela Halilović Sažetak. U radu je okazano kako Mellinova transformacija
Microsoft PowerPoint - Prvi tjedan [Compatibility Mode]
![Microsoft PowerPoint - Prvi tjedan [Compatibility Mode] Microsoft PowerPoint - Prvi tjedan [Compatibility Mode]](/thumbs/99/139589070.jpg) REAKTORI I BIOREAKTORI PODJELA I OSNOVNI TIPOVI KEMIJSKIH REAKTORA Vanja Kosar, izv. prof. KEMIJSKI REAKTOR I KEMIJSKO RAKCIJSKO INŽENJERSTVO PODJELA REAKTORA I OPĆE BILANCE TVARI i TOPLINE 2 Kemijski
REAKTORI I BIOREAKTORI PODJELA I OSNOVNI TIPOVI KEMIJSKIH REAKTORA Vanja Kosar, izv. prof. KEMIJSKI REAKTOR I KEMIJSKO RAKCIJSKO INŽENJERSTVO PODJELA REAKTORA I OPĆE BILANCE TVARI i TOPLINE 2 Kemijski
JMBAG IME I PREZIME BROJ BODOVA MJERA I INTEGRAL završni ispit 6. srpnja (Knjige, bilježnice, dodatni papiri i kalkulatori nisu dozvoljeni!) 1.
 MJERA I INTEGRAL završni ispit 6. srpnja 208. (Knjige bilježnice dodatni papiri i kalkulatori nisu dozvoljeni!). (8 bodova) Kao na predavanjima za d N sa P d : a b ] a d b d ] : a i b i R a i b i za i
MJERA I INTEGRAL završni ispit 6. srpnja 208. (Knjige bilježnice dodatni papiri i kalkulatori nisu dozvoljeni!). (8 bodova) Kao na predavanjima za d N sa P d : a b ] a d b d ] : a i b i R a i b i za i
UDŽBENIK 2. dio
 UDŽBENIK 2. dio Pročitaj pažljivo Primjer 1. i Primjer 2. Ova dva primjera bi te trebala uvjeriti u potrebu za uvo - denjem još jedne vrste brojeva. Primjer 1. Živa u termometru pokazivala je temperaturu
UDŽBENIK 2. dio Pročitaj pažljivo Primjer 1. i Primjer 2. Ova dva primjera bi te trebala uvjeriti u potrebu za uvo - denjem još jedne vrste brojeva. Primjer 1. Živa u termometru pokazivala je temperaturu
NAČINI, POSTUPCI I ELEMENTI VREDNOVANJA UČENIČKIH KOMPETENCIJA IZ NASTAVNOG PREDMETA: MATEMATIKA Na osnovu članka 3., stavka II, te članka 12., stavka
 NAČINI, POSTUPCI I ELEMENTI VREDNOVANJA UČENIČKIH KOMPETENCIJA IZ NASTAVNOG PREDMETA: MATEMATIKA Na osnovu članka 3., stavka II, te članka 12., stavka II i III, Pravilnika o načinima, postupcima i elementima
NAČINI, POSTUPCI I ELEMENTI VREDNOVANJA UČENIČKIH KOMPETENCIJA IZ NASTAVNOG PREDMETA: MATEMATIKA Na osnovu članka 3., stavka II, te članka 12., stavka II i III, Pravilnika o načinima, postupcima i elementima
(Microsoft Word - Dr\236avna matura - rujan vi\232a razina - rje\232enja)
 b. C. Neka je a prost prirodan broj. Tada je a prirodan broj ako i samo ako je b nenegativan cijeli broj (tj. prirodan broj ili nula). Stoga ćemo svaki od zadanih brojeva zapisati kao potenciju čija je
b. C. Neka je a prost prirodan broj. Tada je a prirodan broj ako i samo ako je b nenegativan cijeli broj (tj. prirodan broj ili nula). Stoga ćemo svaki od zadanih brojeva zapisati kao potenciju čija je
Microsoft Word - vezbe 1
 ODELOVAWE DINAI^IH ELEENATA I SISTEA Zadatak Za mehan~ke translatorne ssteme na sl a b ormrat matemat~ke modele te dat ekvvalentne asvne elektr~ne mre`e d m P F P F A B Sl a Sl b Rje{ewe: Uo~mo da sstem
ODELOVAWE DINAI^IH ELEENATA I SISTEA Zadatak Za mehan~ke translatorne ssteme na sl a b ormrat matemat~ke modele te dat ekvvalentne asvne elektr~ne mre`e d m P F P F A B Sl a Sl b Rje{ewe: Uo~mo da sstem
2. Globalna svojstva realnih funkcija Denicija 2.1 Za funkciju f : A kaemo da je:! R; A R ome dena odozgor ako postoji M 2 R takav da je (8x 2 A) (f (
 2. Globalna svojstva realnih funkcija Denicija 2.1 Za funkciju f : A kaemo da je:! R; A R ome dena odozgor ako postoji M 2 R takav da je (8x 2 A) (f (x) M) ; ome dena odozdol ako postoji m 2 R takav da
2. Globalna svojstva realnih funkcija Denicija 2.1 Za funkciju f : A kaemo da je:! R; A R ome dena odozgor ako postoji M 2 R takav da je (8x 2 A) (f (x) M) ; ome dena odozdol ako postoji m 2 R takav da
Microsoft Word - 3. G Markovic D Teodorovic.doc
 XXVII Smpozjum o novm tehnologjama u poštanskom telekomunkaconom saobraćaju PosTel 29, Beograd, 5.. decembar 29. PROBLEM LOCIRANJA ČVOROVA SA KONVERZIJOM TALASNIH DUŽINA U OPTIČKIM TRANSPORTNIM MREŽAMA
XXVII Smpozjum o novm tehnologjama u poštanskom telekomunkaconom saobraćaju PosTel 29, Beograd, 5.. decembar 29. PROBLEM LOCIRANJA ČVOROVA SA KONVERZIJOM TALASNIH DUŽINA U OPTIČKIM TRANSPORTNIM MREŽAMA
Osnove fizike 1
 Sveučilište u Rijeci ODJEL ZA INFORMATIKU Ulica Radmile Matejčić 2, Rijeka Akademska 2018./2019. godina OSNOVE FIZIKE 1 Studij: Preddiplomski studij informatike Godina i semestar: 1. godina; 1. semestar
Sveučilište u Rijeci ODJEL ZA INFORMATIKU Ulica Radmile Matejčić 2, Rijeka Akademska 2018./2019. godina OSNOVE FIZIKE 1 Studij: Preddiplomski studij informatike Godina i semestar: 1. godina; 1. semestar
Sveučilište J.J. Strossmayera Fizika 2 FERIT Predložak za laboratorijske vježbe Određivanje relativne permitivnosti sredstva Cilj vježbe Određivanje r
 Sveučilište J.J. Strossmayera Fizika 2 Predložak za laboratorijske vježbe Cilj vježbe Određivanje relativne permitivnosti stakla, plastike, papira i zraka mjerenjem kapaciteta pločastog kondenzatora U-I
Sveučilište J.J. Strossmayera Fizika 2 Predložak za laboratorijske vježbe Cilj vježbe Određivanje relativne permitivnosti stakla, plastike, papira i zraka mjerenjem kapaciteta pločastog kondenzatora U-I
Primjena neodredenog integrala u inženjerstvu Matematika 2 Erna Begović Kovač, Literatura: I. Gusić, Lekcije iz Matematike 2
 Primjena neodredenog integrala u inženjerstvu Matematika 2 Erna Begović Kovač, 2019. Literatura: I. Gusić, Lekcije iz Matematike 2 http://matematika.fkit.hr Uvod Ako su dvije veličine x i y povezane relacijom
Primjena neodredenog integrala u inženjerstvu Matematika 2 Erna Begović Kovač, 2019. Literatura: I. Gusić, Lekcije iz Matematike 2 http://matematika.fkit.hr Uvod Ako su dvije veličine x i y povezane relacijom
ALIP1_udzb_2019.indb
 Razmislimo Kako u memoriji računala prikazujemo tekst, brojeve, slike? Gdje se spremaju svi ti podatci? Kako uopće izgleda memorija računala i koji ju elektronički sklopovi čine? Kako biste znali odgovoriti
Razmislimo Kako u memoriji računala prikazujemo tekst, brojeve, slike? Gdje se spremaju svi ti podatci? Kako uopće izgleda memorija računala i koji ju elektronički sklopovi čine? Kako biste znali odgovoriti
