UNIVERZITET U SARAJEVU PRIRODNO-MATEMATIČKI FAKULTET AMIRA ČOPRA-JANIĆIJEVIĆ LEJLA KLEPO ANELA TOPČAGIĆ PRAKTIKUM ORGANSKE HEMIJE Univerzitetsko izdan
|
|
|
- Ања Симић
- пре 6 година
- Прикази:
Транскрипт
1
2
3 UNIVERZITET U SARAJEVU PRIRDN-MATEMATIČKI FAKULTET AMIRA ČPRA-JANIĆIJEVIĆ LEJLA KLEP ANELA TPČAGIĆ PRAKTIKUM RGANSKE EMIJE Univerzitetsko izdanje Sarajevo, godina
4 PRAKTIKUM RGANSKE EMIJE Autori Amira Čopra-Janićijević Lejla Klepo Anela Topčagić Izdavač Prirodno-matematički fakultet Recenzenti Prof. dr. Emin Sofić, profesor emeritus Univerzitet u Sarajevu Prof. dr. Milka Maksimović, redovni profesor Prirodno-matematički fakultet Univerziteta u Sarajevu Doc. dr. urija Džudžević-Čančar Farmaceutski fakultet Univerziteta u Sarajevu DTP Autori Naslovna strana Edib Gusinjac, grafički dizajner Štampa CIP - Katalogizacija u publikaciji Nacionalna i univerzitetska biblioteka Bosne i ercegovine, Sarajevo Tiraž (075.8)(076) ČPRA-Janićijević, Amira Praktikum organske hemije / Amira Čopra-Janićijević, Lejla Klepo, Anela Topčagić. - Sarajevo : Prirodno-matematički fakultet, str. : graf. prikazi ; 30 cm Bibliografija: str. 203 ISBN Klepo, Lejla 2. Topčagić, Anela CBISS.B-ID bjavljivanje ovog udžbenika odobrio je Senat Univerziteta u Sarajevu odlukom broj: od godine Na osnovu Zakona o autorskim i srodnim pravima ( Službene novine, br. 7/2002), zabranjeno je svako umnožavanje, fotokopiranje ili bilo kakvo reproduciranje knjige ili njenih dijelova bez odobrenja autora.
5 PRAKTIKUM RGANSKE EMIJE
6
7 PREDGVR Praktikum organske hemije je pisan sa ciljem da omogući prvenstveno studentima hemije Prirodno-matematičkog fakuleta Univerziteta u Sarajevu da na jednom mjestu imaju eksperimentalni dio postojećeg plana i programa obuhvaćenog predmetima rganska hemija I i rganska hemija II. Nadamo se da će Praktikum biti koristan i studentima farmacije, tehnologije i ostalih fakulteta na kojima je organska hemija važan dio studijskog programa, kao i svima onima koji se sa organskom hemijom susreću u svom radu. Praktikum sadrži deset poglavlja koja se odnose na vrste reakcija koje se izučavaju u pomenutim predmetima. Svako poglavlje započinje sa Teorijskim dijelom, uz detaljan prikaz mehanizma svake vrste reakcije koje su vezane za eksperimentalni dio. Također, u svakom poglavlju se nalazi dio Pripremna vježbanja, u kojem se nalaze pitanja i zadaci vezani za vrste reakcija u datom poglavlju. Studenti na takav način mogu proširiti svoje znanje iz date oblasti, te sa većim razumijevanjem pristupiti eksperimentalnom radu. Svako poglavlje prati i Eksperimentalni dio sa većim brojem vježbi, za svako poglavlje. U svakoj vježbi su pregledno date neophodne hemikalije, reagensi, pribor, oprema i iskorištenja navedena u hemijskoj literaturi da se studenti mogu lakše organizovati pri radu. Na kraju svakog od navedenih deset poglavlja, nalazi se Izvještaj, koji je neophodno ispuniti da bi se vježbe iz ovih predmeta uspješno završile. Izvještaj sadrži pitanja iz datog eksperimenta, teorijska pitanja, kao i izračunavanje prinosa sinteze, te tako zaokružuje cjelinu jednog eksperimenta-sinteze, kao i grupe reakcija. Na kraju praktikuma se nalazi koristan Dodatak o osnovnim karakteristikama spojeva, IUPAC nazivi, te fizikalno-hemijske karakteristike što studentima može pomoći pri izvođenju samih eksperimanata. Dodatak sadrži i važan dio o opasnostima koje korištene hemikalije mogu izazvati tokom rada i štetnosti koje mogu izazvati po zdravlje. Studenti se prije svake vježbe trebaju upoznati sa ovim važnim informacijama koje su vezane za date hemikalije u eksperimentalnim procedurama. Nadamo se da će ovaj Praktikum, pomoći studentima u što boljem savladavanju predviđenih nastavnih jedinica iz predmeta rganska hemija I i rganska hemija II, te da će ih osposobiti za predmete koji su nadogradnja ovih programa, a koji se izučavaju u narednim godinama studija. Korisnicima ovog izdanja, prvenstveno studentima upućujemo poziv da nas obavijeste o svojim utiscima, pošalju svoje prijedloge i sugestije kojima ćemo se rado koristiti radi poboljšanja novih izdanja. Autori
8
9 SADRŽAJ 1. Nukleofilne adicije na nezasićenom C-atomu karbonilne grupe Sinteza cimetne kiseline Sinteza N-salicilidenanilina Sinteza benzilidenacetona Sinteza dibenzilidenacetona Sinteza jodoforma Sinteza benzoina Reakcije oksidacije i redukcije ksidacija benzoina u benzil Redukcija benzoina u trans-stilben ksidacija cikloheksanola Disproporcioniranje benzaldehida (Cannizzareva reakcija) Sinteza 9,10-dihidroksistearinske kiseline Nukleofilne acil supstitucije (karboksilne kiseline i derivati) Sinteza metilbenzoata idroliza metilbenzoata Sinteza benzamida idroliza benzamida Sinteza fenilbenzoata Sinteza acetanilida Sinteza N-acetilglicina Nukleofilne supstitucije na zasićenom ugljikovom atomu Sinteza glicina Sinteza 1-brombutana Sinteza terc-butilhlorida Eliminacijske reakcije Sinteza cikloheksena Elektrofilne adicije na dvostruku vezu Sinteza etilenbromida Sinteza 2,3-dibrom-3-fenilpropanske kiseline Elektrofilne aromatske supstitucije Sinteza m-dinitrobenzena Sinteza o- i p-nitrofenola Sinteza p-nitroanilina Sinteza 2,4,6-tribromfenola Sinteza 2,4,6-tribromanilina Sinteza sulfanilne kiseline Dobijanje i reakcije diazonijum soli Sinteza fenola Sinteza jodbenzena Sinteza 1-fenilazo-2-naftola Sinteza 1-(4-hidroksifenilazo)-2-naftola Sinteza 1-(4-nitrofenilazo)-2-naftola Molekulska pregrađivanja Sinteza benzilne kiseline Reakcije radikalskog kuplovanja Sinteza 1,1'-bi-2-naftola Dodatak Literatura 203
10
11 Reakcije oskidacije i redukcije 2. REAKCIJE KSIDACIJE I REDUKCIJE TERIJSKI DI ksidacija je reakcija u kojoj se oksidacijski broj nekog atoma povećava, dok se u reakciji redukcije taj broj smanjuje. Svaki proces oksidacije mora pratiti proces redukcije. Zato takve reakcije i nazivamo reakcijama oksido-redukcije ili, skraćeno, redoks-reakcijama. Redoks reakcije se, osim među anorganskim, zbivaju i među organskim spojevima. Najčešće oksidacije i redukcije se dešavaju na alkoholima, aldehidima i ketonima, te karboksilnim kiselinama. R C 0 oksidacija redukcija R C oksidacija C redukcija R ksidacija je stvaranje veze atoma ugljika sa atomom veće elektronegativnosti, a redukcija je stvaranje veze atoma ugljika s atomom manje elektronegativnosti, pri čemu se mijenja oksidacijsko stanje atoma ugljika. bjašnjenje za takvu definiciju jeste to da promjene u kovalentnoj vezi ukljujčuju veću ili manju gustinu elektrona na atomu ugljika. Adicija atoma vodika na organsku molekulu gotovo se uvijek smatra redukcijskim procesom, pri čemu se često gube heteroatomi. A gotovo sve oksidacije organskih molekula uključuju uvođenje kisika, azota ili hlora, ili gubljenje atoma vodika iz molekule. Pri utvrđivanju oksidacijskih stanja organskih molekula smatra se da je oksidaciono stanje elementarnog ugljika jednako nuli. U metanu, C 4, atom ugljika se nalazi u oksidacijskom stanju -4. Druga krajnost oksidacijskog stanja predstavlja ugljik(iv)-oksid, C 2 u kojem je oksidaciono stanje ugljika +4. Metan i ugljik (IV)-oskid predstavljaju najniže i najviše oksidacijsko stanje ugljika. Većina heteroatoma koji se nalaze u organskim molekulama, elektronegativnija je od ugljika i vezujući se uz njega, ugljik postaje elektropozitivniji. ksidacijsko stanje svakog atoma ugljika u spoju određuje se utvrđivanjem odnosa elektronegativnosti. Uopšteno, pravila su sljedeća: 1. oksidacijsko stanje ugljika mijenja se za -1 za svaku vezu sa vodikom, 2. oksidacijsko stanje ugljika mijenja se za +1 za svaku vezu s elektronegativnijim heteroatomom 3. dvostruke i trostruke veze s heteroatomom daju dva, odnosno tri puta veću vrijednost 4. veze među atomima ugljika se ne računaju pri određivanju oskidacijskog stanja C 2 Cl 2 0 C 3 C N CCl 4 +4 Br C 2 C C
12 Praktikum organske hemije ksidacija sekundarnih alkohola ksidacija alkohola najčešće se vrši reagensima Cr(VI), koji se upotrebljava u obliku Na 2 Cr 2 7, K 2 Cr 2 7 ili Cr 3. Reakcija se odvija u prisustvu jakih mineralnih kiselina tako da je stvarno oksidaciono sredstvo hromna kiselina 2 Cr 4. bjavljeno je godine da vodena otopina natrijium-hipohlorita (NaCl) reagira sa sekundarnim alkoholima u kiseloj sredini i daje ketone sa dobrim iskorištenjem (85-96%): R R C R C 3 C + NaCl R C + + NaCl Uporedimo li ova dva reagensa za oksidaciju alkohola, prednost se daje hipohloritu. ksidacija s hipohloritom ne stvara štetni otpad, krajnji produkti su hlorid i željeni keton bez prisustva štetnih metalnih iona. Međutim, oksidacija alkohola pomoću hromne kiseline ili natrijum-dihromata stvara hrom (III) ion koji je otrov za ribe i bezkičmenjake. rom (III) oksid i njegove soli štetno djeluju na kožu i sluzokožu, a ujedno pokazuju i kancerogeno djelovanje. Ne smije se zaboraviti ni opasna sulfatna kiselina, čija je prisutnost uobičajena u reakciji oksidacije pomoću hrom (VI) iona. Kod izvođenja reakcije oksidacije pomoću hipohlorita bitno je da se spriječi eventualno nekontrolirano oslobađanje hlora. 2 Pretpostavlja se da je oksidans u ovoj reakciji hipohloritna kiselina. Treba istaknuti da je stupanj oksidacije hlora +1 u hipohloritnoj kiselini (Cl). Nedostatak elektrona u valentnoj ljusci Cl + čini ga reaktivnijim od hloridnog iona. Vjerovatni mehanizam ove oksidacije je: R C 3 C + Cl - Cl + C 3 C - R C + Cl R C + R Cl - R R C + R Cl - R C Cl + 2 R R C Cl + 2 R C Cl - R + + C 3 C C 3 C 2 34
13 Reakcije oskidacije i redukcije Cannizzarova reakcija Aldehidi koji nemaju α-vodik ne mogu graditi enolatni ion u baznom mediju, pa tako ne mogu dati ni produkte aldolne kondenzacije. Umjesto toga dolazi do diproporcioniranja: pri čemu se polovina prisutnih molekula oksiduje u kiselinu, a druga polovina se redukuje u alkohol. Dolazi do autooksidacije i autoredukcije aldehida: 2 R C - R C - + RC 2 U prvom stepenu adira se hidroksilna grupa (, nukleofil) na karbonilni ugljikov atom i nastaje "adicijski međuprodukt" koji daje hidrid (vodik s oba vezna elektrona) drugoj molekuli aldehida. Nastaje alkoksid anion i karboksilna kiselina. U drugom stepenu dolazi do brzog prelaza protona s karboksilne kiseline na alkoksid anion i nastaje alkohol i karboksilat anion koji zakiseljavanjem prelazi u odgovarajuću karboksilnu kiselinu. Mehanizam Prvi korak je nukleofilna adicija baze ( - aniona) na C-atom karbonilne grupe aldehida pri čemu nastaje hidratni anion. Nastali anion se deprotonira u jako baznim uslovima i nastaje adicijski Cannizzarov međuprodukt (dianion). vo je oksido-redukcijska reakcija. Alkoholi se formiraju kao rezultat redukcije, a soli karboksilne kiseline kao rezultat oksidacije. + - C C - hidratni anion dianion ba međuprodukta dalje mogu reagovati sa aldehidom u cilju protoniranja (prebacivanja - iona). Transfer - iona simultano stvara alkoksidni ion (RC 2 - ) i karboksilnu kiselinu, koja se brzo deprotonira u karboksilat. 35
14 Praktikum organske hemije hidratni anion - - C + + C C dianion - C - + benzojeva kiselina - + benzilni alkohol - C C benzojeva kiselina benzilni alkohol idroksilacija alkena Prilikom hidroksilacije alkena nastaju dioli (glikoli). Rekacija se sastoji iz dva koraka, oksidacije i hidrolize i teče uz prisustvo osmijum-tetraoksida ili kalijum-permanganata. Reakcija između π-elektrona i elektrona osmijum-tetraoksida ili permanganatnog iona započinje procesom u kome se tri elektronska para istovremeno pomjeraju, nakon čega nastaje ciklični ester. vaj proces se može posmatrati i kao elektrofilni napad na alken: dva elektrona alkena pomjeraju se prema metalu, pri čemu dolazi do redukcije. Iz steričkih razloga produkt može nastati unošenjem dva kisikova atoma sa iste strane dvostruke veze. vaj intermedijer se ne izoluje, već se odmah konvertuje reduktivnom obradom reakcione smjese do slobodnog diola. 36
15 Reakcije oskidacije i redukcije Reakcija sinteze diola preko kalijum-permanganata i osmij-tetraoksida: R R C C R R + Mn 4-2 p iznad 8 R Mn C C R R R CR 2 CR 2 + Mn 2 R R C C R R + s 4 piridin s R C C R R R 2 S ili NaS 3 CR 2 CR 2 + s Clemensova redukcija Clemensova redukcija se koristi za redukciju karbonilne grupe, koja je stabilna u jakim kiselim uslovima, do alkena. U ovoj reakciji reducirajući agens je amalgam cinka u Cl, a C= se redukuje do C 2 grupe. Cijela reakcija se odvija na površini zinkovog amagama. R 1 R 2 Zn - g Cl R 1 C R 2 Mehanizam Clemensove redukcije R 1 R 2 R 1 R 2 R + 1 R 2 2e - + Zn - Zn 2+ R 1 C - R R 1 C 2 + R 2-2 C + R 1 R 2 2e - C - R 1 R 2 + R 1 C R 2 37
16 Praktikum organske hemije PRIPREMNA VJEŽBANJA 1. Izračunati oksidacijsko stanje svakog atoma ugljika u sljedećim molekulama: a) C 3 d) C 3 C C C N 3 C b) C 2 C e) N C C c) C 3 C N C 2 C 3 f) C C 2 Cl 2. Izračunajte ukupnu promjenu oksidacijskog stanja za ugljikove atome u ovim reakcijama? a) 3 C C 2 + Cl 3 C C 3 Cl b) C + C 3 C + c) 3 C Zašto se aldehidi mogu oksidirati do karboksilnih kiselina, a ketoni ne? 4. Navesti tri oksidacijka reagensa koji se mogu koristiti u oksidacijama alkohola: a) b) c) 38
17 Reakcije oskidacije i redukcije 5. Navesti tri redukcijska reagensa koji se mogu koristiti u redukcijama karbonilnih spojeva: Koji aldehidi podliježu Cannizzarovoj reakciji, a koji aldolnoj kondenzaciji? bjasniti! 7. Dovršite slijedeće reakcije: s 4 piridin 1) 33% Na 2) + Cl 3 C Zn - g + C 3 Zn - g + 39
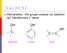
18 Reakcije oskidacije i redukcije 2.5. SINTEZA 9, 10-DIIDRKSISTEARINSKE KISELINE C KMn 4 C 3 Na C C 3 oleinska kiselina 9,10 - dihidroksistearinska kiselina emikalije i reagensi Pribor i oprema leinska kiselina, 0,5 g Balon ravnog dna, 500 ml Natrijum-hidroksid, 0,5 g Menzura, 50 ili 100 ml Kalijum-permanganat, 1%, 25 ml Vodeno kupatilo lorovodonična kiselina, konc., 9,5 ml Čaša, 400 ml Natijum-sulfit, anhidrovani Termometar U balon sa ravnim dnom zapremine 0,5 L dodati 0,5 g oleinske kiseline i 0,5 g natrijumhidroksida prethodno otopljenog u 32 ml vode. Smjesa se pažljivo zagrije (na vodenom kupatilu, uz mješanje) dok se ne otopi sva oleinska kiselina. Nakon što se sva kiselina otopila, prestane se sa zagrijavanjem i doda 250 ml vode pomješane sa ledom. Ako se ne dostigne temperatura reakcione smjese od 5-10 C, potrebno je dodatno hlađenje u ledenom kupatilu. Na ovako ohlađenu smjesu doda se 25 ml 1% rastvora kalijum-permanganata u porcijama tokom jedne minute. Dobijenu smjesu je potrebno dodatno mješati još 5 minuta. Višak kalijum-permanganata se uklanja dodavanjem anhidrovanog natrijum-sulfita. Na reakcionu smjesu se doda 9,5 ml konc. hlorovodonične kiseline, nakon čega se taloži 9,10- dihidroksistearinska kiselina. Nastala kiselina se filtrira na Büchnerovom lijevku i ispere sa malo hladne vode. Prekristalizacija se vrši iz etanola. T. t. 9,10-dihidroksistearinske kiseline je 88 C. Literaturni prinos 0,3g. 53
19 Praktikum organske hemije IZVJEŠTAJ 1. Napisati IUPAC imena za oleinsku i 9,10-dihidroksistearinsku kiselinu? 2. Zašto dodajemo natrijum-sulfit? 3. Zašto se u sintezi pojavljuje višak KMn 4? 4. Izračunati teorijski i literaturni prinos dobivenog produkta. Datum rada: 54
20 Reakcije oskidacije i redukcije 9,10-Dihidroksistearinska kiselina Teorijski prinos: g Molekulska formula: Literaturni prinos: g Molekulska masa: Eksperimentalni prinos: g CAS: T. t. ( C): Iskorištenje: T. k. ( C): Teorijsko % Gustina (g/ml): Literaturno % Čistoća: T.t. (eksp. dobivena) = ºC Napomena/Komentar VJERA VJEŽBE Datum ovjere Potpis asistenta 55
21 Praktikum organske hemije 56
22 Elektrofilne adicije na dvostruku vezu 6. ELEKTRFILNE ADICIJE NA DVSTRUKU VEZU TERIJSKI DI Slabo bazni (nukleofilni) π elektroni dvostruke veze ugljik-ugljik pogodno su mjesto za napad elektrofilnog reagensa. Napadom elektrofila dolazi do obrazovanja karbkationa kao međuprodukta, koji stupa u reakciju sa nukleofilom. Elektrofilni reagensi nose pozitivni naboj ili sadrže atome sa nepotpunom valencijskom ljuskom koju teže da popune kombinacijom sa π elektronima. S obzirom da su nepotpune elektronske konfiguracije, elektrofilni agensi su veoma reaktivni. Mehanizam jedne takve reakcije se može prikazati opštim primjerom reakcije adiranja hidrogenhalida (Cl, Br itd) na alken: R 2 C CR 2 + X R 2 C CR 2 + X alken hidrogen halid karbkation anion R 2 C CR 2 karbkation (elektrofil) + X halidni ion (nukleofil) R 2 C CR 2 X alkil halid Najjednostavnija reakcija dvostruke veze je njeno zasićenje vodikom. va reakcija obično teče u prisustvu katalizatora platine, paladija ili nikla. Tako se dešavaju i neke reakcije halogeniranja, npr. bromiranje alkena. Bromiranje alkena uključuje intermedijarnu reakciju elektrona dvostruke veze sa polarizovanim molekulama broma, pri čemu nastaju π kompleksi. Međuprodukt može reagovati i sa drugim kationima osim bromonijum-iona. Ako je u reakciju uveden i hloridni ion, dolazi do obrazovanja smjese dibromida i brom-hlorida. Tročlani prsten π kompleksa u međuproduktu je iznad prividne ravni molekule sa dvostrukom vezom. Nukleofil napada sa suprotne strane, što rezultira transadicijom. Reakcija adicije broma je praćena promjenom boje, tako da služi za dokazivanje dvostruke veze, odnosno nezasićenosti u organskim spojevima. Alkeni po pravilu obezboje otopinu broma, a sa otopinom kalijum-permaganata daju smeđi precipient. Navedene reakcije mogu izostati ako je dvostruka veza alkena deaktivirana elektronakceptornim grupama ili ako su alkeni slabo topivi u reakcionoj sredini. Pozitivnu reakciju sa bromom i kalijum-permanganatom daju i neki obojeni spojevi podložni 115
23 Praktikum organske hemije oksidacijama. Aldehidi, fenoli i aromatski amini reaguju sa kalijum-permaganatom. Fenoli i amini lako reaguju sa bromom. Alkeni adiraju halogenvodike dajući alkilhalogenide. Kod nesimetričnih alkena orijentacija pri adiciji se vrši u skladu sa Markovnikovim pravilom (X se adira na nesimetrični alken tako da polazno protoniranje daje stabilniji karbkation, pa se proton sa halogenvodika vezuje za ugljik koji ima veći broj vezanih atoma vodika). Izvjesni strukturni detalji i prisustvo peroksida pri adiciji dovode do odstupanja od Markovnikovog pravila. Prilikom oksidacije alkena moguće su reakcije epoksidacije, hidroksilacije i ozonolize (oksidativno raskidanje). Alkeni se dobijaju isključivo reakcijom eliminacije iz alkohola i alkilhalogenida. Dehidratacija alkohola se pospješuje zagrijavanjem i dodavanjem kiselog katalizatora ( 2 S 4, 3 P 4 ). Upotrebom sulfatne kiseline može doći do oksidacije, pri čemu se kiselina redukuje do sumpor-dioksida. Fosfatna kiselina ne izaziva nepoželjne oksidacije, ali su reakcije sporije. Lakoća dehidratacije alkohola opada u nizu tercijarni > sekundarni > primarni. Pri dehidrataciji dolazi do kidanja veze ugljik-kisik i obrazovanja najstabilnijeg karbonijum-iona, tako da reakcije mogu biti praćene premještanjem. Uslijed nemogućnosti rotacije oko dvostruke veze, alkeni egzistiraju u obliku cis- i trans-izomera. Alkilhalogenidi gube halogenvodike i grijanjem sa kalijum-hidroksidom u etanolu. Industrijski alkeni se dobijaju katalitičkom dehidrogenacijom iz alkana. 116
24 Elektrofilne adicije na dvostruku vezu PRIPREMNA VJEŽBANJA 1. Navesti bar pet reagenasa koji se mogu adirati na 1-propen? Koja vrsta spojeva nastaje pri svakoj adiciji. 2. Dva izomerna alkena, 2-metil-2-penten i 2-etil-1-buten su početni spojevi koji se mogu koristiti. A. 2-metil-2-penten (C 3 ) 2 C=CC 2 C 3 B. 2-etil-1-buten (C 3 C 2 ) 2 C=C 2 Koristeći komponentu A ili B kao početni spoj, uz odabir odgovarajućeg regensa, predloži način pripreme sljedećih produkata. Produkt dgovor 3-pentanon C 3 C 2 CC 2 C 3 2-metilpentan C 3 C 2 C 2 C(C 3 ) 2 Spoj Reagens Spoj Reagens Reagens 1. Br metill-2,3-pentandiol (C 3 ) 2 C()CC 2 C 3 3-brom-3-metilpentan C 3 C 2 CBr(C 3 )C 2 C 3 Spoj Reagens Spoj Reagens 3.KMn 4 u Definisati Markovnikovo pravilo. Pod kojim uslovima se vrše adicije suprotno Markovnikovom pravilu? 117
25 Praktikum organske hemije 4. Napisati mehanizam adicije Cl na 4-metilcikloheksen? 5. Na primjeru 3-til-2-pentena prikazati reakcije sa sljedećim reaktanima: a) 2 /Pd b) KMn 4 c) Br 2 6. Koja se vrsta jedinjenja dobiva hidroksilacijom, a koja hidrogenizacijom alkena? Navesti reakcione uslove i reagense. 118
26 Praktikum organske hemije 6.2. SINTEZA 2,3-DIBRM-3-FENILPRPANSKE KISELINE Br Br + Br 2 / acetatna kiselina trans-cimetna kiselina 2,3-dibrom-3-fenilpropanska kiselina emikalije i reagensi Pribor i oprema trans-cimetna kiselina, 1,5g Dvogrli balon okruglog dna, 50 ml Glacijalna acetatna kiselina, 6,0 ml Libigovo hladilo Brom u 1M acetatnoj kiselini Lijevak za dokapavanje Erlenmeyerova tikvica Büchnerov lijevak U dvogrli okrugli balon od 50 ml, pomiješati 10 mmol trans-cimetne kiseline (1,5g) i 6,0 ml glacijalne acetatne kiseline. Tikvicu postaviti na vodeno kupatilo koje se nalazi na magnetnoj mješalici, a na tikvicu postaviti povratno hladilo i lijevak za dokapavanje. Vodeno kupatilo zagrijati do 50 C. U lijevak za dokapavanje dodati 10,0 ml 1M rastvora broma u acetatnoj kiselini. Kada se postigla temperatura od 50 C, dodati smjesu brom/acetatna kiselina u pet ili više porcija čekajući da boja postane svijetlo narandžasta prije nego što se doda sljedeća porcija. Cimetna kiselina bi se trebala rastvoriti ubrzo nakon dodatka prve porcije. Nakon dodatka zadnje porcije nastaviti zagrijavanje na 50 C slijedećih 15 min. U slučaju da smjesa postane skoro bezbojna za vrijeme ovih 15 minuta, dodati još koju kap smjese brom/acetatna kiselina dok se boja ne zadrži. Ako smjesa ima drugačiju narandžastu boju dodati kap ili dvije cikloheksena da bi postala svijetlo žuta. Reakcijsku smjesu prebaciti u Erlenmeyerovu tikvicu i hladiti u ledenom kupatilu 15 min. Nastale kristale filtrirati na Büchnerovom lijevku. Prekristalizaciju dobivenog produkta uraditi iz 50 % etanola. T.k. eritro-2,3-dibrom-3-fenilpropanska kiselina 204 C treo-2,3-dibrom-3-fenilpropanska kiselina 95 C 122
27 Elektrofilne adicije na dvostruku vezu IZVJEŠTAJ 1. bjasniti šta znači eritro, a šta treo u nazivu dobijenog produkta? 2. Zašto je potrebno dodavati smjesu brom/acetatna kiselina dok se boja ne zadrži? 3. Izračunati teorijski i literaturni prinos dobivenog produkta. Datum rada: 123
28 Praktikum organske hemije 2,3-Dibrom-3-fenilpropanska kiselina Teorijski prinos: g Molekulska formula: Literaturni prinos: g Molekulska masa: Eksperimentalni prinos: g CAS: T. t. ( C): Iskorištenje: T. k. ( C): Teorijsko % Gustina (g/ml): Literaturno % Čistoća: T.t. (eksp. dobivena) = ºC Napomena/Komentar VJERA VJEŽBE Datum ovjere Potpis asistenta 124
29 Elektrofilne aromatske supstitucije 7. ELEKTRFILNE ARMATSKE SUPSTITUCIJE TERIJSKI DI Karakteristične reakcije aromatskih spojeva su reakcije elektrofilne supstitucije gdje se vrši zamjena jednog (ili više) vodika na benzenovoj jezgri sa elektrofilom. Tipične reakcije elektrofilne supstitucije su: nitriranje, halogeniranje, sulfonovanje, te Friedel-Crafts-ovo aciliranje i alkiliranje. Zajedničko svim reakcija elektrofilne aromatske supstitucije jeste upotreba kiselog katalizatora. Elektrofilna supstitucija na aromatskoj jezgri je reakcija koja se odvija u dva stepena, od kojih je prvi stepen adicija elektrofila na aromatsku jezgru, nakon koje, u drugom brzom stepenu, slijedi eliminacija protona: pšti primjer mehanizma elektrofilne aromatske suspstitucije se može prikazati: E + E E E + + E Primjeri reakcija elektrofilne aromatske supstitucije su date u tabeli 3. Tabela 3: Pregled reakcija elektrofline aromatske supstitucije Tip reakcije Reakcija Elektrofil alogeniranje X 2 FeX 3 X Cl + ili Br + Nitriranje N 3 2 S 4 N 2 N 2 + Sulfoniranje Friedel-Craftsovo alkiliranje S 3 S 3 S S 4 AlX 3 + RX + X R + R Friedel-Craftsovo aciliranje AlX X R X R R + 125
30 Praktikum organske hemije Već postojeći supstituenti na aromatskom prstenu određuju tok sljedeće elektrofilne supstitucije. Supstituenti se mogu razvrstati u tri kategorije: Aktivatori (supstituenti prvog reda ili elektron-donori) "aktiviraju" aromatsku jezgru u reakcijama elektrofilne supstitucije i reakcija se odvija brže nego na benzenu. ni usmjeravaju ulazak drugog supstituenta u orto- i para-položaj. voj grupi pripadaju: NR 2, N 2,,, NCR, R, R. dnos orto- i para- supstitucije ovisi o prostornim zahtjevima aktivatora. Što je takav aktivator veći, to su veće i prostorne (steričke) smetnje za napad na susjedni orto-položaj, pa udio para-produkta raste. Deaktivatori (supstituenti drugog reda ili elektron-akceptori) "deaktiviraju" aromatsku jezgru u reakcijama elektrofilne supstitucije i usmjeravaju ulazak drugog supstituenta u metapoložaj. Reakcija se odvija sporije u poređenju sa benzenom. voj grupi pripadaju: N 2, C, S 3, CN 2, CN, CCl 3, CR, CR, N 3 +. alogeni kao supstituenti predstavljaju posebnu grupu, deaktiviraju aromatsku jezgru, ali usmjeravaju supstituciju u orto- i para-položaj. Za uvođenje trećeg supstituenta na disupstituiranim aromatskim spojevima i predviđanje njegovog položaja supstitucije u odnosu na dva već postojeća supstituenta važe neka generalna pravila: Aktivirajuće (o-,p-) grupe imaju prednost nad deaktivirajućim (m-) grupama. bično se više stvara p-supstitucionih derivata nego o-supstitucionih zbog steričkih smetnji. 1,2,3-trisupstituisani produkti rijetko se formiraju zbog steričkih efekata. Grupe koje imaju mogućnost rezonancije imaju prednost nad grupama koje posjeduju induktivni efekat. Na primjeru aromatskog spoja sa dva supstituenta sa različitim direkcionim uticajem, prilikom uvođenja narednog supstituenta grupe koje imaju aktivirajuće dejstvo sa o- i p- direkcionim uticajem usmjeravaju tj. određuju mjesto pozicije narednom supstituentu. 126
31 Elektrofilne aromatske supstitucije o-, p- uticaj C 3 m-uticaj N2 N 3 /2S4 2 N C 3 sterički efekat N 2 formira se jako malo produkta C 3 N2 N 2 glavni produkt Kako je već spomenuto 1,2,3-supstituenti se teže stvaraju zbog steričkih smetnji. Ako imamo dva susptituenta koja imaju isto npr. aktivirajuće dejstvo sa istim direkcionim uticajem na benzenu, ako jedna grupa ima mogućnost rezonancije (R), a druga posjeduje induktivni efekat (I), prednost imaju grupe koje imaju mogućnost rezonancije tj. ulaze u konjugaciju sa dvostrukim vezama iz benzena i one određuju mjesto pozicije narednog supstituenta, u odnosu na grupe koje imaju samo induktivni efekat. R C 3 C 3 N 3 / 2 S 4 N 2 C 3 + I C 3 glavni produkt Naftalen također podliježe reakciji elektrofilne aromatske supstitucije prema istom mehanizmu kao i benzen. Prilikom reakcije sa odgovarajućim elektrofilom, supstitucija se vrši regioselektivno na C1-atomu. + E + E E glavni produkt sporedni produkt 127
32 Praktikum organske hemije Prilikom napada elektrofila na položaj C2, nastali međuprodukt ima samo jednu rezonancionu strukturu u kojoj je očuvan benzenov prsten, za razliku od napada na C1, gdje postoje dvije takve rezonancione strukture. Nitriranje Nitriranje benzena sa koncentrovanom nitratnom kiselinom nije moguće na umjerenim temperaturama. Razlog je da azot nitratne grupe ima malu elektrofilnu sposobnost, pa ga je potrebno nekako aktivirati. To se može postići protoniranjem N 3 sa sulfatnom kiselinom. Gubitkom vode dobija se nitronijum-ion, N 2 +, jak elektrofil kod koga je pozitivan naboj skoncentrisan na atomu azota. N + nitratna kiselina + + S 4 - S 3 + N + + N S S 4 N + nitronijum-ion Nitriranje aromatskih spojeva upotrebljava se kao jedan od stupnjeva u sintezi mnogih spojeva. Nitro-grupa se može uvesti kao supstituent koji usmjerava ulazak narednog supstituenta u meta- položaj. Uslovi pod kojima se izvodi reakcija nitriranja zavise od reaktivnosti organskog spoja. Nitriranje se može izvesti na više načina: nitratnom kiselinom različitih koncentracija, smjesom za nitriranje koja se sastoji od koncentrovane sulfatne i koncentrovane nitratne kiseline u omjeru 1 : 1, alkalijskim nitratima uz koncentrovanu sulfatnu kiselinu, nitratnom kiselinom uz glacijalnu acetatnu kiselinu ili anhidrid acetatne kiseline, zavisno od supstrata. Uvođenje jedne nitro grupe je egzotermna reakcija, te se reakcija provodi uz hlađenje ledom, da se spriječi oksidativno djelovanje nitratne kiseline. Dok je za mononitriranje dovoljna smjesa za nitriranje, uvođenje druge nitro grupe iziskuje upotrebu pušljive nitratne kiseline. Primjena pušljive nitratne kiseline kod nitriranja fenola dovela bi do burne egzotermne reakcije, pa se zbog toga koriste alkalijski nitrati. Nitriranjem fenola nastaju orto- i parasupstitucioni produkti. idroksilna grupa je supstituent koji daje elektrone i tako stabiliziran međuprodukt cikloheksadienil-kation. Prilikom adicije na orto- i para- položaj javlja se delokalizacija pozitivnog naboja između hidroksilnog atoma kisika i prstena. Četiri strukture daju povoljan doprinos rezonancionom hibridu i smanjuju energiju međuprodukta (orto- i para-međuprodukti imaju po jednu 128
33 Elektrofilne aromatske supstitucije strukturu u kojoj je pozitivan naboj u susjedstvu supstituenta, dok sličnog međudjelovanja nema u toku meta supstitucije). rto napad E + E E E E najstabilnija rezonantna forma kisika i svi ugljikovi atomi imaju postignut oktet elektrona Para napad E + E E E E najstabilnija rezonantna forma kisika i svi ugljikovi atomi imaju postignut oktet elektrona Meta napad E + E E E slobodni elektronski parovi ne učestvuju u stabilizaciji pozitivnog naboja niti jedne od prikazanih struktura Kod orto-nitrofenola susrećemo tzv. intramolekularnu vodikovu vezu (unutar jedne molekule) i pojavu tzv. orto efekta, koju izazivaju supstituenti u aromatskom prstenu koji se nalaze na susjednim ugljikovim atomima tj. u orto-položaju benzena. To su supstituenti u 129
34 Praktikum organske hemije parovima: N 2 i, C i, C i, CC 3 i. vi spojevi ključaju na nižoj temperaturi. Nitriranjem anilina već uz blage uslove nastaje polinitroanilin, zbog toga što amino-grupa spada u aktivatore koji vrlo jako aktiviraju benzenovo jezgro i čine je reaktivnijom od samog benzena. Kako bi se to izbjeglo i dobio željeni mononitro-derivat (p-nitroanilin), amino grupa se može prevesti u amid tako da se acetilira. Nastaje acetanilid, spoj s manje aktivirajućom grupom (-NCC 3 ), koji nitriranjem daje mononitro-derivat (p-nitroacetanilid). idrolizom p-nitroacetanilida oslobađa se amino-grupa i nastaje p-nitroanilin. idroliza se može provesti s kiselinama ili bazama. Nastali p-nitroanilin se koristi za proizvodnju azo-bojila, te kao intermedijer u laboratorijskim sintezama koje daju spojeve koji se ne mogu inače lako sintetizirati. alogeniranje Benzen je pod normalnim uslovima nereaktivan u prisustvu halogena zbog toga što halogeni nisu dovoljno reaktivni da naruše aromatičnost prstena. Međutim, halogen se može aktivirati Lewisovim kiselinama, kao što su feri-halogenidi, FeX 3, ili aluminijum halogenidi, AlX 3, pri čemu postaje znatno jači elektrofil. Do aktivacije dolazi tako da Lewisove kiseline imaju sposobnost da prihvate elektronske parove. Kada halogen, kao što je brom djeluje pomoću FeBr 3, dolazi do kiselinsko-bazne reakcije Lewisovog tipa. Br Br + FeBr 3 Br Br FeBr 3 Br + Br FeBr 3 U ovom kompleksu je Br-Br veza polarizovana, što daje elektrofilni karakter jednom od bromovih atoma. Elektrofilni napad na benzen vrši se preko terminalnog atoma broma, dok drugi dio molekule čini dobro odlazeća grupa FeBr Br Br FeBr 3 Br + FeBr 4 - FeBr 4 - koji nastaje u ovoj fazi djeluje kao baza koja uklanja proton iz heksadienil-kationskog intermedijera. vom reakcijom se dobivaju dva proizvoda, brombenzen i hidrogenbromid, a regeneriše se i katalizator FeBr 3. Br Br + Br FeBr 3 + Br + FeBr 3 130
35 Elektrofilne aromatske supstitucije Uvođenje drugog atoma broma ili halogena uopšteno je otežano zbog deaktivirajućeg djelovanja supstituisanog broma. Deaktivaciono djelovanje halogena se javlja zbog induktivnog efekta. va reakcija je egzotermna. Egzotermnost halogeniranja aromatskih spojeva opada u nizu: F 2 >Cl 2 >Br 2 >I 2. Fluoriranje je jako egzotermna reakcija tako da je reakcija sa benzenom eksplozivna, a reakcija sa I 2 je endotermna. Sulfonovanje Pušljiva sulfatna kiselina vrši elektrofilni napad pomoću S 3. Zbog jakog elektron-privlačnog dejstva tri kisikova atoma, sumpor iz S 3 je dovoljno elektrofilan da direktno napadne benzen. Eliminacijom protona koja slijedi, dobija se sulfonovani proizvod, benzensulfonska kiselina. + S S - S Reakcija sulfonovanja je reverzibilna. Reakcija sumpor-trioskida sa vodom, pri čemu nastaje sulfatna kiselina, toliko je egzotermna da se zagrijavanjem benzensulfonske kiseline razblaženom kiselinom mijenja tok reakcije ka suprotnom smjeru. idratacija S 3 S + 2 S + Desulfonovanje S 3 2, 2 S 4, 100 o C + S 3 Reverzibilnost sulfonovanja može se upotrijebiti za kontrolu daljih aromatičnih supstitucija na prstenu. Blokiran je ugljikov atom za koji je vezan supstituent, i eletrofili napadaju druga mjesta na prstenu. Iz tog razloga se sulfonska grupa može uvesti i upotrijebiti kao dirigujuća zaštitna grupa i zatim ukloniti desulfonovanjem. 131
36 Praktikum organske hemije Sulfonovanje supstituiranih benzena se koristi u proizvodnji deterdženata. Račvasti alkilbenzeni dugog niza se sulfonuju u odgovarajuće sulfonske kiseline, koje se zatim prevode u natrijumove soli. Druga primjena sulfonovanja je u proizvodnji boja, zbog toga što sulfonska grupa omogućava rastvorljivost obojenih organskih molekula u vodi. Friedel-Crafts-ovo alkiliranje i aciliranje va dva tipa elektrofilne aromatske supstitucije su u odnosu na druge reakcije jedine koje omogućavaju formiranje ugljik-ugljik veze. U reakciji alkiliranja nastaje karbkation sposoban da stupi u elektrofilnu aromatsku supstitucija formirajući aril-ugljik vezu. U ovu svrhu se mogu upotrebljavati halogenalkani, alkeni, alkoholi u prisustvu Lewisove ili mineralne kiseline. U slučaju Friedel-Crafts-ovog aciliranja reakcija se odvija uz učešče intermedijera acilijumkationa koji dalje stupa u elektrofilnu aromatsku susptituciju dajući ogovarajuće aromatske spojeve. 132
37 Elektrofilne aromatske supstitucije PRIPREMNA VJEŽBANJA 1. Zašto benzen ne učestvuje u reakcijama adicije? 2. Zbog čega su fenoli kiseliji od alkohola (pka = 8-10)? 3. Grupe koje su prikazane u narednoj tabeli označiie kao aktivatore (A) ili deaktivatore (D), i označiti da li imaju o-, m- ili p- orijentaciju. Grupa A ili D o-i p- o-i p- Grupa A ili D ili m- ili m- Grupa -N 2 -R (+) -NR 3 -Br -C -N 2 -CN F -C CR -CN 2 -NCC 3 -S 2 R -Cl -CC 3 -S 3 -C 2 -C 6 5 -C 2 R -NR 2 -I (+) -SR 2 -C 2 Cl -R -C=CN 2 - ( ) (+) -PR 3 A ili D o-i p- ili m- 4. Koje su pojave karakteristične za orto-supstituente? 5. Zašto se koristi smjesa N 3 / 2 S 4 prilikom nitriranja benzena? Ko ima ulogu kiseline, a ko baze? 133
38 Praktikum organske hemije 6. Dovršiti sljedeće reakcije: N Cl + Br + (C 3 C) 2 AlCl 3 CS 2 C(C 3 ) 2 N 3 2 N 2 S 4 Br 2 CCl 3 7. Napisati mehanizam nitriranja brombenzena! 134
39 Elektrofilne aromatske supstitucije 8. Dovršiti sljedeće reakcije: 3 C C 3 (C 3 C) 2 AlCl 3 Cl Cl N 3 2 S 4 2 N C N 3 2 S 4 N(C 3 ) 2 2Cl 2 2 N C 3 2 S 4 S 3 2Br 2 Fe 2 N 9. Dovršiti sljedeće reakcije i imenovati nastale produkte : Cl 2 S 4 Cl S 3 3 C C 3 Cl 2 Fe C 3 C 3 Cl N 3 2 S 4 135
40 Praktikum organske hemije 3 C C 3 N 3 2 S 4 C bjasniti zašto kod fenola i anilina dolazi do polisupstitucije. 11. Zašto nitriranjem anilina uz N 3 / 2 S 4 nastaje m-derivat, a ne o- i p-derivat? 136
41 Elektrofilne aromatske supstitucije EKSPERIMENTALNI DI 7.1. SINTEZA m-dinitrbenzena N 2 N 3 (pušljiva), 2 S 4 N 2 N 2 nitrobenzen m-dinitrobenzen emikalije i reagensi Pribor i oprema Nitrobenzen, 4,2 ml (5 g) Balon ravnog dna, 250 ml Sulfatna kiselina, konc., 8 ml Pipeta, 5 i 10 ml Nitratna kiselina, pušljiva, 5 ml Čaša, 100 i 400 ml Etanol Erlenmeyerova tikvica, 150 ml Lijevak Vodeno kupatilo Büchnerov lijevak U balon ravnog dna od 250 ml pomiješa se 5 ml pušljive nitratne kiseline sa 8 ml koncentrovane sulfatne kiseline. Miješanje ovih kiselina mora se izvoditi pažljivo uz hlađenje balona spolja hladnom vodom. U balon sa smjesom za nitriranje postepeno se dodaje 4,2 ml (5 g) nitrobenzena (u digestoru) uz stalno miješanje. Reakciona smjesa zagrijava se u otvorenom balonu u vodenom kupatilu 30 minuta uz često miješanje. Prohlađena smjesa izlije se uz miješanje u čašu sa 100 ml hladne vode pri čemu se izdvaja čvrsti m-dinitrobenzen u obliku taloga. Talog se filtrira na Büchnerovom lijevku i ispere vodom. Prekristalizacija se vrši iz etanola. T. t. m-dinitrobenzena je 89,9 o C. Literaturni prinos 3 g. 137
42 Praktikum organske hemije IZVJEŠTAJ 1. Zašto se koristi pušljiva N 3 u sintezi m-dinitrobenzena? 2. Ako je eksperimentalni prinos sinteze dinitrobenzena 70%, izračunati volumen nitrobenzena koji je potreban da bi se dobilo 3 g dinitrobenzena! 3. Izračunati teorijski i literaturni prinos dobivenog produkta. Datum rada: 138
43 Elektrofilne aromatske supstitucije Teorijski prinos: g Literaturni prinos: g Eksperimentalni prinos: g Iskorištenje: Teorijsko % Literaturno % m-dinitrobenzen Molekulska formula: Molekulska masa: CAS: T. t. ( C): T. k. ( C): Gustina (g/ml): Čistoća: T.t. (eksp. dobivena) = ºC Napomena/Komentar VJERA VJEŽBE Datum ovjere Potpis asistenta 139
44 Praktikum organske hemije 7.2. SINTEZA o- i p- NITRFENLA KN3, 2 S N 2 2 N N 2 fenol o-nitrofenol p-nitrofenol m-nitrofenol 55 % 45 % < 1 % emikalije i reagensi Kalijum-nitrat, 9,6 g Natrijum-nitrat, 8 g Sulfatna kiselina, konc., 5,5 ml Fenol, 5 g Natrijum-hidroksid, 2 mol/dm 3, 35mL Natrijum-hidroksid, 30 %, 3 ml Metanol lorovodonična kiselina, 2 mol/dm 3 Pribor i oprema Baloni ravnog dna, 250 i 500 ml Menzura, 50 ili 100 ml Pipeta, 1 i 10 ml Lijevak za dokapavanje Termometar Liebigovo hladilo Lijevak Čaše, 100, 250 i 400 ml Büchnerov lijevak Sinteza o-nitrofenola U balon ravnog dna od 250 ml otopi se, uz blago zagrijavanje, u 20 ml vode 9,5 g kalijumnitrata ili 8 g natrijum-nitrata. U ohlađenu otopinu ulije se oprezno, uz miješanje, 5,5 ml koncentrovane sulfatne kiseline. Kada se smjesa ohladi na 20 o C, doda se iz lijevka za dokapavanje, uz češće mućkanje, smjesa od 5 g kristalnog fenola i 0,5 ml vode. U slučaju da se fenol ne otopi potrebno je blago zagrijati. Prilikom unošenja fenola u reakcionu smjesu, potrebno je održavati temperaturu smjese između 20 i 25 o C. Nakon stajanja od dva sata smjesa se razblaži dvostrukom količinom vode i ostavi da se slegne. Vodeni sloj se dekantira i odvoji od ulja, te ispere vodom dva puta. Uljasti ostatak se destilira vodenom parom, pri čemu destilira samo o-nitrofenol. U slučaju da supstanca očvrsne u cijevi hladila, zaustavi se dovod vode u hladilo za kratko vrijeme da vrela para otopi kristale. Žuti očvrsnuli kristali filtriraju se preko Büchnerovog lijevka i osuše se između filter papira. Čisti produkt se dobiva prekristalizacijom iz vrućeg metanola. Nakon hlađenja o-nitrofenol kristalizira u obliku prizmi. T. t. o-nitrofenola je 45 o C. Literaturni prinos 3g. 140
45 Elektrofilne aromatske supstitucije Sinteza p-nitrofenola Za dobivanje p-nitrofenola ostatak iza destilacije vodenom parom (u balonu od 250 ml) pomiješa se sa 35 ml Na c=2 mol/dm 3 i aktivnim ugljikom i prokuha. Nakon filtriranja preko običnog lijevka tekućina se upari na volumen od oko 15 ml i tome doda 3 ml 30% Na. Nastala natrijumova so razlaže se dodatkom razblažene Cl u toplom i provjeri lakmus papirom. Pri tome se izlučuje p-nitrofenol u obliku ulja, koje nakon hlađenja prelazi u čvrsto stanje. Prekristalizacija se vrši iz vruće vode uz dodatak kiseline. T. t. p-nitrofenola je 114 o C. Literaturni prinos 0,8 g. Šematski prikazati aparaturu za destilaciju vodenom parom pomoću koje se razdvajaju o- i p- nitrofenol. 141
46 Praktikum organske hemije IZVJEŠTAJ 1. Zašto se o-nitrofenol može destilirati vodenom parom? 2. Izračunati teorijski i literaturni prinos dobivenog o-nitrofenola. Datum rada: 3. Zašto se dodaje Cl prilikom sinteze p-nitrofenola? 4. Izračunati teorijski i literaturni prinos dobivenog p-nitrofenola. Datum rada: 142
47 Elektrofilne aromatske supstitucije Teorijski prinos: g Literaturni prinos: g Eksperimentalni prinos: g Iskorištenje: Teorijsko % Literaturno % o-nitrofenol Molekulska formula: Molekulska masa: CAS: T. t. ( C): T. k. ( C): Gustina (g/ml): Čistoća: T.t. (eksp. dobivena) = ºC Teorijski prinos: g Literaturni prinos: g Eksperimentalni prinos: g Iskorištenje: Teorijsko % Literaturno % p-nitrofenol Molekulska formula: Molekulska masa: CAS: T. t. ( C): T. k. ( C): Gustina (g/ml): Čistoća: T.t. (eksp. dobivena) = ºC Napomena/Komentar VJERA VJEŽBE Datum ovjere Potpis asistenta 143
48 Praktikum organske hemije 7.3. SINTEZA p-nitranilina SINTEZA p-nitracetanilida NCC 3 NCC 3 N 3 / 2 S 4 acetanilid 2 N p-nitroacetanilid emikalije i reagensi Pribor i oprema Acetanilid 6,75 g (0,05 mol) Erlenmeyerova tikvica, 250 ml Acetatna kiselina, glacijalna, 7,5 ml Lijevak za dokapavanje Sulfatna kiselina, konc., 15 ml Termometar Nitratna kiselina, konc., 3,5 ml Čaša, 250 i 400 ml Büchnerov lijevak U Erlenmeyerovu tikvicu stavi se 6,75 g čistog acetanilida i doda 7,5 ml glacijalne acetatne kiseline i oprezno zagrijava dok se čitav acetanilid ne otopi. topina se ohladi u ledenom kupatilu, te joj se doda polako, uz miješanje 10 ml ohlađene konc. 2 S 4. Iz lijevka za dokapavanje polako se dodaje prethodno pripremljena hladna smjesa za nitriranje sastavljena od 3,5 ml konc. N 3 i 5 ml konc. 2 S 4 uz neprekidno miješanje. Temperatura reakcijske smjese tokom dokapavanja mora biti C (termometar postaviti u reakcijsku smjesu). Kad je sva kiselina dodana, reakcijska smjesa se ostavi na sobnoj temperaturi oko 40 minuta. Zatim se reakcijska smjesa prenese polako, uz miješanje, u smjesu od 100 ml 2 i smrvljenog leda (pri čemu sirovi produkt kristalizira) i ostavi da kristalizira još 15 min do potpune kristalizacije. Talog se odsiše pomoću Büchnerovog lijevka, dobro ocijedi i prenese s filter-papira u čašu sa oko 80 ml vode pri čemu se stvara pasta. Ponovo se odsiše i dobro ispere vodom da se ukloni kiselina. Suhi, sirovi p-nitroacetanilid je dovoljno čist i može se upotrijebiti odmah za sintezu p-nitroanilina. 144
49 Elektrofilne aromatske supstitucije SINTEZA p-nitranilina NCC 3 Cl, 2 N 3 + Cl - N 4 N 2 2 N -C 3 C 2 N -N 4 Cl N p-nitroacetanilid p-nitroanilin emikalije i reagensi Pribor i oprema p-nitroacetanilid, sinetiziran Erlenmeyerova tikvica, 250 ml lorovodonična kiselina, konc., 35 ml Menzura Amonijum-hidroksid, konc.,40 ml Liebigovo hladilo Čaša, 400 ml Büchnerov lijevak U Erlenmeyerovu tikvicu od 250 ml stavi se sirovi p-nitroacetanilid (sintetiziran u prvom dijelu vježbe) i doda 30 ml vode i 35 ml konc. Cl. Smjesa se lagano zagrijava (refluksira) uz povratno vodeno hladilo minuta. p-nitroacetanilid se postepeno otapa i stvara se narandžasto obojena, bistra otopina p-nitroanilina u obliku hlorida (pnitroanilinhidrogenhlorid). Sirovi produkt se postepeno prenese u smjesu od 40 ml konc. otopine aminijum-hidroksida i 150 ml vode i smrvljenog leda uz neprekidno miješanje. Konačna smjesa mora biti izrazito bazna (provjera pomoću indikator-papira). Narandžastožuti kristali p-nitroanilina se odsišu kroz Büchnerov lijevak i peru hladnom vodom. Prekristalizacija iz vruće vode. T. t. p-nitroanilina je 148 C. Literaturni prinos 6 g. 145
50 Praktikum organske hemije IZVJEŠTAJ 1. Zašto konačna smjesa mora biti izrazito bazna? 2. Da li pri sintezi p-nitroacetanilida nastaje o-izomer? bjasniti. 3. Zašto se za sintezu p-nitroanilina koristi kao polazni spoj acetanilin, a ne anilin? 4. Izračunati teorijski i literaturni prinos dobivenog produkta. Datum rada: 146
51 Elektrofilne aromatske supstitucije Teorijski prinos: g Literaturni prinos: g Eksperimentalni prinos: g Iskorištenje: Teorijsko % Literaturno % p-nitroanilin Molekulska formula: Molekulska masa: CAS: T. t. ( C): T. k. ( C): Gustina (g/ml): Čistoća: T.t. (eksp. dobivena) = ºC Napomena/Komentar VJERA VJEŽBE Datum ovjere Potpis asistenta 147
52 Praktikum organske hemije 7.4. SINTEZA 2,4,6-TRIBRMFENLA Br 3Br 2 / 2 + 3Br Br Br fenol 2,4,6-tribromfenol emikalije i reagensi Pribor i oprema Fenol, 5 %, 4 ml Erlenmeyerova tikvica, 250 ml Bromna voda, 3 %, 35 ml Menzura, 50 ml Etanol, 50 %, 5 ml Lijevak za odvajanje Büchnerov lijevak Vodeno kupatilo Čaša, 200 ml U Erlenmejerovu tikvicu od 250 ml stavi se 4 ml 5 % vodene otopine fenola i doda 20 ml vode. Iz lijevka za odvajanje, koji sadrži 35 ml 3 % vodene otopine broma, dodaje se u Erlenmejerovu tikvicu kap po kap bromne vode uz stalno mućkanje tikvice. Kada se poslije dužeg mućkanja crvenosmeđa boja broma zadrži, prestane se sa dodavanjem broma. Stvoreni talog se filtrira kroz Büchnerov lijevak i ispere nekoliko puta vodom. Sirovi tribromfenol se prekristalizira uz dodatak 20 ml toplog etanola i uz zagrijavanje na vodenom kupatilu. Dobivena otopina se filtrira u čistu čašu, doda se 40 ml vode zagrijane na o C, dobro se promućka i ostavi da kristalizira. Stvoreni talog se filtrira preko Büchnerovog lijevka, ispere sa 5 ml hladnog 50 % etanola i ostavi da se suši. T.t. 2,4,6-tribromfenola je 95 o C. Literaturni prinos 0,5 g. 148
53 Elektrofilne aromatske supstitucije IZVJEŠTAJ 1. Kako dobiti monobromfenol? 2. Kakva je razlika u pogledu kiselosti fenola i alkohola? 3. Šta se dešava sa bromom u prisustvu otapala kao što je voda? 4. Izračunati teorijski i literaturni prinos dobivenog produkta. Datum rada: 149
54 Praktikum organske hemije Teorijski prinos: g Literaturni prinos: g Eksperimentalni prinos: g Iskorištenje: Teorijsko % Literaturno % 2,4,6-Tribromfenol Molekulska formula: Molekulska masa: CAS: T. t. ( C): T. k. ( C): Gustina (g/ml): Čistoća: T.t. (eksp. dobivena) = ºC Napomena/Komentar VJERA VJEŽBE Datum ovjere Potpis asistenta 150
55 Dobijanje i reakcije diayonijum soli 8. DBIJANJE I REAKCIJE DIAZNIJUM SLI TERIJSKI DI Diazonijum soli su jako korisni međuprodukti u sintezama mnogih aromatskih spojeva kao što su fenoli, arilhalogenidi, arilcijanidi, aromatski ugljikovodici i diazospojevi. Reakcije amina sa nitritnom kiselinom vrše se nukleofilnim napadom nitrozil-kationa, N +. Da bismo dobili N + mora se prvo sintetizirati nestabilna nitritna kiselina. na se priprema u reakciji vodene otopine Cl sa natrijum-nitritom. U tako kiselom rastvoru nastaje ravnoteža sa nitrozilkationom. Cl Na N N N N N -NaCl natrijum-nitrit nitritna kiselina nitrozil-kation + 2 Nitrozil-kation je elektrofilan i napadaju ga amini gradeći N-nitrozoamonijum-so. N + N N N N-nitrozoamonijum-so Primarni aromatski amini daju sa nitritnom kiselinom u vodenim otopinama na 0 o C relativno stabilne diazonijum soli. Sekundarni aromatski amini sa nitritnom kiselinom daju kao i alifatski sekundarni amini N-nitrozo spojeve koji se u kiseloj sredini pregrađuju u p-nitrozo derivate. Tercijarni aromatski amini za razliku od alifatskih ne daju N-nitrozo spojeve, već C- nitrozo spojeve. N 2 + N 2 N N NaN 2 / Cl Cl - Nitritna kiselina je izvor sredstva za nitroziranje na koje se amin supstituira. Tada slijedi niz koraka u kojima se dešavaju prenosi protona nakon čega otcjepljenjem vode nastaje diazonijum-ion. 157
56 Praktikum organske hemije N N + + N N - + diazonijumhidroksid N N + N N N N - 2 diazonijum ion Diazonijeve soli dobivene iz primarnih aromatskih amina relativno su stabilne na temperaturi od oko 0 C, pa se koriste za sintezu drugih organskih spojeva. U ovim reakcijama, grupa - N 2 Cl- (ili -N 2 S 4 - ) se zamjeni s -, -Cl, -Br, -CN, -I, itd. Tu se dešava reakcija nukleofilne supstitucije, pri čemu je (N 2 ) odlazeća grupa. N N N N + Nu Nu Aril-kation veoma lako stupa u reakciju sa hidroksidnim ionima iz vode dajući fenol. Reakcija teče prema S N 1 mehanizmu. Iskorištenje za fenol je bolje ako se koristi diazonijum sulfat umjesto diazonijum hlorida zbog toga što hloridni ion lakše stupa u reakciju sa aril međuproduktom od sulfatnih iona i na taj način konkuriše supstituciji hidroksilnih iona. U organskoj sintezi široku primjenu ima Sandmeyerova reakcija, gdje se supstitucija azota odvija u prisutnosti jednovalentnog bakra. Ion bakra uzrokuje cijepanje C-N veze diazonijeve soli i stvaranje aromatskog karbkationa, kojeg zatim nukleofilno napada prisutni anion bakarnih soli dajući odgovarajući produkt. Za ove procese vjeruje se da se odvijaju mehanizmom slobodnih radikala. Reakcija je korisna za sintezu jer je supstitucija diazonijeve grupe regiospecifična; to znači da se supstrat povezuje samo s onim ugljikom na koje je prethodno bila vezana amino-grupa. Primjer jedne takve reakcije je dobivanje hlorbenzena iz anilina. N 2 N NCl Cl NaN 2 / Cl CuCl 0 C Anioni u solima bakra mogu biti različiti, a najčešće se uz CuCl koriste CuBr i CuCN, tako da pored hlorida, najstaju odgovarajući bromidi i cijanidi. 158
57 Dobijanje i reakcije diayonijum soli Schiemannova reakcija je vrlo sličan proces u kojem dolazi do termičkog raspada diazonijtetrafluorborata. U modificiranoj verziji te reakcije upotrebljava se heksafluorofosfatna kiselina. Aromatske diazonijum soli podliježu reakcijama koje teku i bez gubitka azota. U ovu grupu spadaju reakcije redukcije do hidrazina i diazokuplovanje u kojima nastaju arilazofenoli i arilazoamini. Kod reakcija kuplovanja obično glavni produkt nastaje reakcijom terminalonog azotovog atoma s atomom supstrata koji je u para položaju prema aktivirajućoj grupi. Diazonijum ion reaguje kao elektrofilni agens i supstituira vodik u aromatskom supstratu. N N + X N N X - 2 N N X Ishod reakcije uveliko ovisi od prirode supstituenta (X) vezanog na aromatski supstrat. Kuplovanje teče samo u slučaju ako je supstituent jak aktivator kao što su -, -N(C 3 ) 2 ili grupe. Brzina reakcije kuplovanja diazonijum soli sa fenolima i aminima zavisi od vrijednosti p. Diazonijum ion, kao relativno slab elektrofil može uspješno stupiti u reakciju sa fenoksidnim ionom i slobodnim aminima, koji egzistiraju u baznoj sredini. Slobodni fenoli i amonijum ion ( N 3 +, -N 2 R + ) nisu podesni za nukleofilni napad. Supstituenti kao -,- N 2 snažnije aktiviraju benzenski sistem u para položaj od grupa, odnosno N 3 +. Iz tog razloga amini se ne kupluju u obliku soli, odnosno u kiseloj sredini. Fenoli se prevode u odgovarajući anion na p=11, a kako je fenoksidni ion više aktiviran i podesniji za supstituciju, optimalni uslovi kuplovanja fenola su oko p=11. ptimalni uslovi kuplovanja aromatskih amina postižu se u neutralnoj, odnosno baznoj sredini od p = 7-9. Reakcioni produkti diazokuplovanja su obično obojeni spojevi sa mnogo konjugiranih veza i imaju široku primjenu u industriji boja. 159
Prezentacja programu PowerPoint
 Aromatski ugljikovodici benzen II dio Karakterističan tip reakcije benzena i njegovih derivata. Benzen podliježe reakciji supstitucije u prisustvu elektrofilne čestice ("+" naelektrisana čestica kod koje
Aromatski ugljikovodici benzen II dio Karakterističan tip reakcije benzena i njegovih derivata. Benzen podliježe reakciji supstitucije u prisustvu elektrofilne čestice ("+" naelektrisana čestica kod koje
Alkeni nastavak
 Alkeni nastavak 2. Dehidratacija alkohola U industriji: prevođenjem alkoholnih para preko Al 2 O 3 (Lewis-ova kiselina). Laboratorijsko dobijanje Akohol može biti: 3, 2 ili 1. THF tetrahidrofuran -rastvarač
Alkeni nastavak 2. Dehidratacija alkohola U industriji: prevođenjem alkoholnih para preko Al 2 O 3 (Lewis-ova kiselina). Laboratorijsko dobijanje Akohol može biti: 3, 2 ili 1. THF tetrahidrofuran -rastvarač
Chapter 23
 Poglavlje 23: Estarski enolati i Claisen-ova kondenzacija Podsećanje: aldolna kondenzacija Claisen-ova kondenzacija Kiseo proton Mehanizam: Adicija-eliminacija 1. korak: formiranje estarskog enolata Alkoksid
Poglavlje 23: Estarski enolati i Claisen-ova kondenzacija Podsećanje: aldolna kondenzacija Claisen-ova kondenzacija Kiseo proton Mehanizam: Adicija-eliminacija 1. korak: formiranje estarskog enolata Alkoksid
Министарство просвете, науке и технолошког развоја ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 22. април године ТЕСТ ЗА 8. РАЗРЕД Шифра ученика Српско хемијско
 Министарство просвете, науке и технолошког развоја ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 22. април 2018. године ТЕСТ ЗА 8. РАЗРЕД Шифра ученика Српско хемијско друштво (три слова и три броја) УПИШИ Х ПОРЕД НАВЕДЕНЕ
Министарство просвете, науке и технолошког развоја ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 22. април 2018. године ТЕСТ ЗА 8. РАЗРЕД Шифра ученика Српско хемијско друштво (три слова и три броја) УПИШИ Х ПОРЕД НАВЕДЕНЕ
Microsoft Word - Test 2009 I.doc
 Ime i prezime (ŠTAMPANIM SLOVIMA!!!) jedinstveni matični broj građana (prepisati iz lične karte) broj prijave Test za prijemni ispit iz hemije 1. Hemijska promena je: a) rastvaranje NaCl b) sublimacija
Ime i prezime (ŠTAMPANIM SLOVIMA!!!) jedinstveni matični broj građana (prepisati iz lične karte) broj prijave Test za prijemni ispit iz hemije 1. Hemijska promena je: a) rastvaranje NaCl b) sublimacija
Prezentacja programu PowerPoint
 Aromatski ugljikovodici benzen Vanilin je esencijalna komponenta ulja vanilije dobivenog iz orhideje Vanilla fragrans. To je drugi najskuplji začin (poslije šafrana) Benzaldehid (iz višanja, breskvi,
Aromatski ugljikovodici benzen Vanilin je esencijalna komponenta ulja vanilije dobivenog iz orhideje Vanilla fragrans. To je drugi najskuplji začin (poslije šafrana) Benzaldehid (iz višanja, breskvi,
Zadaci
 Hemijski fakultet Univerziteta u Beogradu Prijemni ispit, 30. jun 2013. godine Test iz hemije Ime i prezime:. Redni broj prijave:. Napomena: Test raditi isključivo plavom ili crnom hemijskom olovkom. Vreme
Hemijski fakultet Univerziteta u Beogradu Prijemni ispit, 30. jun 2013. godine Test iz hemije Ime i prezime:. Redni broj prijave:. Napomena: Test raditi isključivo plavom ili crnom hemijskom olovkom. Vreme
Microsoft Word - Vježba 5.
 5. MASTI I ULJA Pokus 1. ODREĐIVANJE JODNOG BROJA MASLINOVOG I SUNCOKRETOVOG ULJA Jodni broj izražava u postotcima onu količinu joda koju može vezati adicijom neka mast (ulje) ili masna kiselina. Nezasićene
5. MASTI I ULJA Pokus 1. ODREĐIVANJE JODNOG BROJA MASLINOVOG I SUNCOKRETOVOG ULJA Jodni broj izražava u postotcima onu količinu joda koju može vezati adicijom neka mast (ulje) ili masna kiselina. Nezasićene
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун
 РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун 2014. године ТЕСТ ЗНАЊА ЗА VII РАЗРЕД Шифра ученика
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун 2014. године ТЕСТ ЗНАЊА ЗА VII РАЗРЕД Шифра ученика
Regionalno_test_VIII_2013_hemija
 РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕГИОНАЛНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ (7. април 2013. године) ТЕСТ ЗНАЊА ЗА VIII РАЗРЕД Шифра ученика: Пажљиво прочитај
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕГИОНАЛНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ (7. април 2013. године) ТЕСТ ЗНАЊА ЗА VIII РАЗРЕД Шифра ученика: Пажљиво прочитај
Pretvorba metana u metanol korištenjem metalnih oksida
 PRETVORBA METANA U METANOL KORIŠTENJEM METALNIH OKSIDA Ružica Tomašević Kolegij: Anorganski reakcijski mehanizmi Asistent: mag. chem. Vinko Nemec Nositelj kolegija: doc. dr. sc. Vladimir Stilinović 11.
PRETVORBA METANA U METANOL KORIŠTENJEM METALNIH OKSIDA Ružica Tomašević Kolegij: Anorganski reakcijski mehanizmi Asistent: mag. chem. Vinko Nemec Nositelj kolegija: doc. dr. sc. Vladimir Stilinović 11.
KEM KEMIJA Ispitna knjižica 2 OGLEDNI ISPIT KEM IK-2 OGLEDNI ISPIT 12 1
 KEM KEMIJA Ispitna knjižica 2 OGLEDNI ISPIT 2 Prazna stranica 99 2 OPĆE UPUTE Pozorno pročitajte sve upute i slijedite ih. Ne okrećite stranicu i ne rješavajte zadatke dok to ne odobri dežurni nastavnik.
KEM KEMIJA Ispitna knjižica 2 OGLEDNI ISPIT 2 Prazna stranica 99 2 OPĆE UPUTE Pozorno pročitajte sve upute i slijedite ih. Ne okrećite stranicu i ne rješavajte zadatke dok to ne odobri dežurni nastavnik.
Katolički školski centar Sv. Josip Sarajevo Srednja medicinska škola ISPITNI KATALOG ZA ZAVRŠNI ISPIT IZ KEMIJE U ŠKOLSKOJ / GODINI Predme
 Katolički školski centar Sv. Josip Sarajevo Srednja medicinska škola ISPITNI KATALOG ZA ZAVRŠNI ISPIT IZ KEMIJE U ŠKOLSKOJ 2017. / 2018. GODINI Predmetno povjerenstvo za kemiju: Antonija Almaš - Ivković,
Katolički školski centar Sv. Josip Sarajevo Srednja medicinska škola ISPITNI KATALOG ZA ZAVRŠNI ISPIT IZ KEMIJE U ŠKOLSKOJ 2017. / 2018. GODINI Predmetno povjerenstvo za kemiju: Antonija Almaš - Ivković,
Савез хемичара и технолога Македоније Такмичења из хемије за ученике основних и средњих школа ШИФРА: (уноси комисија по завршетку тестирања овде и на
 Савез хемичара и технолога Македоније Такмичења из хемије за ученике основних и средњих школа ШИФРА: (уноси комисија по завршетку тестирања овде и на коверту) ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 6 април, 2019
Савез хемичара и технолога Македоније Такмичења из хемије за ученике основних и средњих школа ШИФРА: (уноси комисија по завршетку тестирања овде и на коверту) ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 6 април, 2019
AROMATSKI KARBOHIDROGENI
 AROMATSKI KARBOHIDROGENI Benzaldehid (iz višanja, breskvi, badema) Toluen (iz Tolu balzama) Benzen, C 6 H 6, Michael Faraday, 1825. London izoliran iz uljnog ostatka gasa za osvjetljenje 1791-1867 Kekuléov
AROMATSKI KARBOHIDROGENI Benzaldehid (iz višanja, breskvi, badema) Toluen (iz Tolu balzama) Benzen, C 6 H 6, Michael Faraday, 1825. London izoliran iz uljnog ostatka gasa za osvjetljenje 1791-1867 Kekuléov
Министарство просветe и спортa Републике Србије
 Министарство просветe и спортa Републике Србије Српско хемијско друштво Републичко такмичење из хемије 21.05.2005. Тест за I разред средње школе Име и презиме Место и школа Разред Не отварајте добијени
Министарство просветe и спортa Републике Србије Српско хемијско друштво Републичко такмичење из хемије 21.05.2005. Тест за I разред средње школе Име и презиме Место и школа Разред Не отварајте добијени
Microsoft PowerPoint - TPOI_07&08_Halogeniranje & Alkilacija_(produkti) [Compatibility Mode]
![Microsoft PowerPoint - TPOI_07&08_Halogeniranje & Alkilacija_(produkti) [Compatibility Mode] Microsoft PowerPoint - TPOI_07&08_Halogeniranje & Alkilacija_(produkti) [Compatibility Mode]](/thumbs/101/151947582.jpg) Fakultet kemijskog inženjerstva i tehnologije Diplomski studij: Kemijsko inženjerstvo Kolegij: Tehnološki procesi organske industrije Izv. prof. dr. sc. Hrvoje Kušić PROCES HALOGENIRANJA Proces kojim se
Fakultet kemijskog inženjerstva i tehnologije Diplomski studij: Kemijsko inženjerstvo Kolegij: Tehnološki procesi organske industrije Izv. prof. dr. sc. Hrvoje Kušić PROCES HALOGENIRANJA Proces kojim se
1 Vježba 11. ENERGETSKE PROMJENE PRI OTAPANJU SOLI. OVISNOST TOPLJIVOSTI O TEMPERATURI. Uvod: Prilikom otapanja soli u nekom otapalu (najčešće je to v
 1 Vježba 11. ENERGETSKE PROMJENE PRI OTAPANJU SOLI. OVISNOST TOPLJIVOSTI O TEMPERATURI. Uvod: Prilikom otapanja soli u nekom otapalu (najčešće je to voda) istodobno se odvijaju dva procesa. Prvi proces
1 Vježba 11. ENERGETSKE PROMJENE PRI OTAPANJU SOLI. OVISNOST TOPLJIVOSTI O TEMPERATURI. Uvod: Prilikom otapanja soli u nekom otapalu (najčešće je to voda) istodobno se odvijaju dva procesa. Prvi proces
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун
 РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун 2014. године ТЕСТ ЗНАЊА ЗА VIII РАЗРЕД Шифра ученика
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун 2014. године ТЕСТ ЗНАЊА ЗА VIII РАЗРЕД Шифра ученика
Alkeni ili olefini – CnH2n
 ALKENI ili olefini C n H 2n Sadrže dvostruku C=C vezu Važan strukturni elemenat i funkcionalna grupa u organskoj hemiji Oblik molekule uvjetovan je prisustvom ove veze Dvostruka veza je mjesto na kojem
ALKENI ili olefini C n H 2n Sadrže dvostruku C=C vezu Važan strukturni elemenat i funkcionalna grupa u organskoj hemiji Oblik molekule uvjetovan je prisustvom ove veze Dvostruka veza je mjesto na kojem
ZADACI_KEMIJA_2008_1_A
 RAZREDBENI ISPIT 2008. (GRUPA A) ŠIFRA: Rješenje svakog zadatka treba označiti u Tablici s rješenjima znakom «X». U svakom zadatku samo je jedan predloženi odgovor točan. Svaki točno riješeni zadatak donosi
RAZREDBENI ISPIT 2008. (GRUPA A) ŠIFRA: Rješenje svakog zadatka treba označiti u Tablici s rješenjima znakom «X». U svakom zadatku samo je jedan predloženi odgovor točan. Svaki točno riješeni zadatak donosi
Univerzitet u Nišu Prirodno-matematički fakultet Departman za hemiju Prijemni ispit za upis na Osnovne akademske studije hemije na PMF-u u Nišu školsk
 Univerzitet u Nišu Prirodno-matematički fakultet Departman za hemiju Prijemni ispit za upis na Osnovne akademske studije hemije na PMF-u u Nišu školske 2019/20. godine Test se popunjava zaokruživanjem
Univerzitet u Nišu Prirodno-matematički fakultet Departman za hemiju Prijemni ispit za upis na Osnovne akademske studije hemije na PMF-u u Nišu školske 2019/20. godine Test se popunjava zaokruživanjem
Uputstva za takmičare: Zadatak (broj) Ukupan broj bodova na testu: 100 Bodovi
 Uputstva za takmičare: Zadatak (broj) Ukupan broj bodova na testu: 100 Bodovi 1. 6. 4. 5 4. 8 5. 8 6. 7. 8 8. 4 9. 5 10. 8 11. 1. 1. 14. 15. 5 16. 4 17. 5 18. 5 19. 6 0. 4 1.. Za izradu testa planirano
Uputstva za takmičare: Zadatak (broj) Ukupan broj bodova na testu: 100 Bodovi 1. 6. 4. 5 4. 8 5. 8 6. 7. 8 8. 4 9. 5 10. 8 11. 1. 1. 14. 15. 5 16. 4 17. 5 18. 5 19. 6 0. 4 1.. Za izradu testa planirano
MEHANIZAM DJELOVANJA ALKOHOL DEHIDROGENAZE
 MEHANIZAM DJELOVANJA ALKOHOL DEHIDROGENAZE Viktorija Medvarić Skupina oksidoreduktaza (E.C. 1.1.1.1) Koenzim NAD(P)H Interkonverzija alkohola u aldehid/keton U arhejama, bakterijama i eukariotima Tip I,
MEHANIZAM DJELOVANJA ALKOHOL DEHIDROGENAZE Viktorija Medvarić Skupina oksidoreduktaza (E.C. 1.1.1.1) Koenzim NAD(P)H Interkonverzija alkohola u aldehid/keton U arhejama, bakterijama i eukariotima Tip I,
ФАКУЛТЕТ ТЕХНИЧКИХ НАУКА ОДСЕК ЗА ПРОИЗВОДНО МАШИНСТВО ПРОЈЕКТОВАЊЕ ТЕХНОЛОГИЈЕ ТЕРМИЧКЕ ОБРАДЕ ХЕМИЈСКО ДЕЈСТВО ОКОЛИНЕ У ПРОЦЕСИМА ТЕРМИЧКЕ ОБРАДЕ -
 ФАКУЛТЕТ ТЕХНИЧКИХ НАУКА ОДСЕК ЗА ПРОИЗВОДНО МАШИНСТВО ПРОЈЕКТОВАЊЕ ТЕХНОЛОГИЈЕ ТЕРМИЧКЕ ОБРАДЕ ХЕМИЈСКО ДЕЈСТВО ОКОЛИНЕ У ПРОЦЕСИМА ТЕРМИЧКЕ ОБРАДЕ - РАДНО - ПРИРЕДИО: ДОЦ. ДР АЛЕКСАНДАР МИЛЕТИЋ SADRŽAJ
ФАКУЛТЕТ ТЕХНИЧКИХ НАУКА ОДСЕК ЗА ПРОИЗВОДНО МАШИНСТВО ПРОЈЕКТОВАЊЕ ТЕХНОЛОГИЈЕ ТЕРМИЧКЕ ОБРАДЕ ХЕМИЈСКО ДЕЈСТВО ОКОЛИНЕ У ПРОЦЕСИМА ТЕРМИЧКЕ ОБРАДЕ - РАДНО - ПРИРЕДИО: ДОЦ. ДР АЛЕКСАНДАР МИЛЕТИЋ SADRŽAJ
PowerPoint Presentation
 ŠTA JE TO ORGANSKA HEMIJA I ZAŠTO JE PROUČAVAMO? ORGANSKO-PRIRODNO- HEMIJSKO-HEMIKALIJA? Organska hemija ili Svijet karbona Organske supstance (npr. maslinovo ulje, šećer, škrob, svila, guma, papir, penicilin
ŠTA JE TO ORGANSKA HEMIJA I ZAŠTO JE PROUČAVAMO? ORGANSKO-PRIRODNO- HEMIJSKO-HEMIKALIJA? Organska hemija ili Svijet karbona Organske supstance (npr. maslinovo ulje, šećer, škrob, svila, guma, papir, penicilin
FENOLI
 FENLI FENLI imaju grupu direktno vezanu na benzenov prsten i spadaju u ARMATSKE SPJEVE. Naziv fenol koristi se i za specifičan spoj, C 6 H 5 i za cijelu klasu spojeva. Sam FENL, otkriven je 1834. god.
FENLI FENLI imaju grupu direktno vezanu na benzenov prsten i spadaju u ARMATSKE SPJEVE. Naziv fenol koristi se i za specifičan spoj, C 6 H 5 i za cijelu klasu spojeva. Sam FENL, otkriven je 1834. god.
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE I
 Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 009. PISANA
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 009. PISANA
Osnove organske hemije Alkeni, nomenklatura, dobivanje i reakcije
 Osnove organske hemije Alkeni, nomenklatura, dobivanje i reakcije Opšta formula C n H 2n Nastavak je en Alkeni Funkcionalna grupa: C=C veza. Nezasićeni ugljikovodici podliježu reakcijama adicije. Prvi
Osnove organske hemije Alkeni, nomenklatura, dobivanje i reakcije Opšta formula C n H 2n Nastavak je en Alkeni Funkcionalna grupa: C=C veza. Nezasićeni ugljikovodici podliježu reakcijama adicije. Prvi
6-STRUKTURA MOLEKULA_v2018
 ELEKTRNSKE STRUKTURNE FRMULE SADRŽAJ: 1. LEWISVE STRUKTURE 1.1. koraci u crtanju Lewisovih struktura 1.2. odstupanje od pravila okteta 2. GEMETRIJA MLEKULA 2.1. uvod 2.2. koraci u riješavanju problema
ELEKTRNSKE STRUKTURNE FRMULE SADRŽAJ: 1. LEWISVE STRUKTURE 1.1. koraci u crtanju Lewisovih struktura 1.2. odstupanje od pravila okteta 2. GEMETRIJA MLEKULA 2.1. uvod 2.2. koraci u riješavanju problema
Microsoft PowerPoint - Šesti tjedan.pptx
 REKCIJSKO INŽENJERSTVO I KTLIZ KINETIK i MEHNIZM HOMOGENO KTLITIČKIH REKCIJ Vanja Kosar, izv. prof. Kod homogene katalize, reaktanti, produkti i katalizator nalaze se u istom agregatnom stanju Brzina homogeno
REKCIJSKO INŽENJERSTVO I KTLIZ KINETIK i MEHNIZM HOMOGENO KTLITIČKIH REKCIJ Vanja Kosar, izv. prof. Kod homogene katalize, reaktanti, produkti i katalizator nalaze se u istom agregatnom stanju Brzina homogeno
PowerPoint Presentation
 OSNOVE ORGANSKE HEMIJE Šta je to organska hemija i zašto je proučavamo Organska hemija ili Svijet ugljika/karbona Organske supstance (npr. maslinovo ulje, šeder, škrob, svila, guma, papir, penicilin )
OSNOVE ORGANSKE HEMIJE Šta je to organska hemija i zašto je proučavamo Organska hemija ili Svijet ugljika/karbona Organske supstance (npr. maslinovo ulje, šeder, škrob, svila, guma, papir, penicilin )
Diapositive 1
 KARBOHIDROGENI (UGLJIKOVODICI) ALIFATSKI AROMATSKI CIKLIČKI ACIKLIČKI ALKANI ALKENI ALKINI Alkani Sadrže samo C i H Opća formula C n H 2n+2 Svi C atomi su sp 3 hibridizirani U molekulama se nalaze samo
KARBOHIDROGENI (UGLJIKOVODICI) ALIFATSKI AROMATSKI CIKLIČKI ACIKLIČKI ALKANI ALKENI ALKINI Alkani Sadrže samo C i H Opća formula C n H 2n+2 Svi C atomi su sp 3 hibridizirani U molekulama se nalaze samo
Министарство просветe и науке Републике Србије
 Министарство просветe и науке Републике Србије Српско хемијско друштво Републичко такмичење из хемије Ниш, 21.05.2011. Тест за I разред средње школе Име и презиме Место и школа Разред Не отварајте добијени
Министарство просветe и науке Републике Србије Српско хемијско друштво Републичко такмичење из хемије Ниш, 21.05.2011. Тест за I разред средње школе Име и презиме Место и школа Разред Не отварајте добијени
Diapositive 1
 Karbonilni spojevi aldehidi i ketoni snove organske hemije Karbonilna jedinjenja aldehidi i ketoni Aldehidi i ketoni organska jedinjenja koja u svojoj strukturi sadrže karbonilnu grupu karbonilna jedinjenja:
Karbonilni spojevi aldehidi i ketoni snove organske hemije Karbonilna jedinjenja aldehidi i ketoni Aldehidi i ketoni organska jedinjenja koja u svojoj strukturi sadrže karbonilnu grupu karbonilna jedinjenja:
ОПШТА И НЕОРГАНСКА ХЕМИЈА ИНТЕГРИСАНЕ АКАДЕМСКЕ СТУДИЈЕ ФАРМАЦИЈЕ ПРВА ГОДИНА СТУДИЈА школска 2015/2016.
 ОПШТА И НЕОРГАНСКА ХЕМИЈА ИНТЕГРИСАНЕ АКАДЕМСКЕ СТУДИЈЕ ФАРМАЦИЈЕ ПРВА ГОДИНА СТУДИЈА школска 2015/2016. Предмет: ОПШТА И НЕОРГАНСКА ХЕМИЈА Предмет се вреднује са 9 ЕСПБ. Недељно има 6 часова активне
ОПШТА И НЕОРГАНСКА ХЕМИЈА ИНТЕГРИСАНЕ АКАДЕМСКЕ СТУДИЈЕ ФАРМАЦИЈЕ ПРВА ГОДИНА СТУДИЈА школска 2015/2016. Предмет: ОПШТА И НЕОРГАНСКА ХЕМИЈА Предмет се вреднује са 9 ЕСПБ. Недељно има 6 часова активне
Microsoft PowerPoint - IR-Raman1 [Compatibility Mode]
![Microsoft PowerPoint - IR-Raman1 [Compatibility Mode] Microsoft PowerPoint - IR-Raman1 [Compatibility Mode]](/thumbs/101/149990971.jpg) Spektar elektromagnetnoga t zračenja 10 5 10 3 10 1 10-1 10-3 10-5 10-7 E(kJ/mol) 10-6 10-4 10-2 1 10 2 10 4 10-8,cm X UV zrake zrake prijelazi elektrona IR mikrovalovi radiovalovi vibracije rotacije prijelazi
Spektar elektromagnetnoga t zračenja 10 5 10 3 10 1 10-1 10-3 10-5 10-7 E(kJ/mol) 10-6 10-4 10-2 1 10 2 10 4 10-8,cm X UV zrake zrake prijelazi elektrona IR mikrovalovi radiovalovi vibracije rotacije prijelazi
Министарство просветe и науке Републике Србије
 Министарство просветe и науке Републике Србије Српско хемијско друштво Републичко такмичење из хемије Ниш, 21.05.2011. Тест за II разред средње школе Име и презиме Место и школа Разред Не отварајте добијени
Министарство просветe и науке Републике Србије Српско хемијско друштво Републичко такмичење из хемије Ниш, 21.05.2011. Тест за II разред средње школе Име и презиме Место и школа Разред Не отварајте добијени
OKFH2-05
 DVOKOMPONENTNI SISTEMI SA IZDVAJANJEM ČVRSTE FAZE RAVNOTEŢA FAZA Prisutna samo tečna faza (pritisak je konstantan): F c p 1 2 1 1; F 2 U ravnoteži tečna i (jedna) čvrsta faza: F c p 1 2 2 1; F 1 ln x L
DVOKOMPONENTNI SISTEMI SA IZDVAJANJEM ČVRSTE FAZE RAVNOTEŢA FAZA Prisutna samo tečna faza (pritisak je konstantan): F c p 1 2 1 1; F 2 U ravnoteži tečna i (jedna) čvrsta faza: F c p 1 2 2 1; F 1 ln x L
Diapositive 1
 KARBNILNI SPJEVI Najvažnija funkcionalna grupa u organskoj hemiji c o Aldehidi i ketoni Zastupljeni su u prirodi Doprinose ukusu i mirisu hrane Pomožu djelovanju mnogih enzima Koriste se kao reagensi i
KARBNILNI SPJEVI Najvažnija funkcionalna grupa u organskoj hemiji c o Aldehidi i ketoni Zastupljeni su u prirodi Doprinose ukusu i mirisu hrane Pomožu djelovanju mnogih enzima Koriste se kao reagensi i
Microsoft Word - informator 2015-priprema.doc
 ИНФОРМАТОР 29 UNIVERZITET U BEOGRADU jun 2005. godine KLASIFIKACIONI ISPIT IZ HEMIJE ZA UPIS NA TEHNOLOŠKO-METALURŠKI FAKULTET U BEOGRADU Šifra zadatka: 51501 Test ima 20 pitanja. Netačan odgovor donosi
ИНФОРМАТОР 29 UNIVERZITET U BEOGRADU jun 2005. godine KLASIFIKACIONI ISPIT IZ HEMIJE ZA UPIS NA TEHNOLOŠKO-METALURŠKI FAKULTET U BEOGRADU Šifra zadatka: 51501 Test ima 20 pitanja. Netačan odgovor donosi
PowerPoint Presentation
 Anorganski reakcijski mehanizmi: klasifikacija Nino Jukić 14. svibnja 2019. Sadržaj Što je mehanizam? razvoj reakcijskih mehanizama kroz povijest (općenito i anorganska kemija) elementi glavnih skupina
Anorganski reakcijski mehanizmi: klasifikacija Nino Jukić 14. svibnja 2019. Sadržaj Što je mehanizam? razvoj reakcijskih mehanizama kroz povijest (općenito i anorganska kemija) elementi glavnih skupina
Primena instrumentalnih metoda na analizu uzoraka vode Zoran Simi ć, master inženjer tehnologije Tehnološko-metalurški fakultet Univerziteta u Beograd
 Primena instrumentalnih metoda na analizu uzoraka vode Zoran Simi ć, master inženjer tehnologije Tehnološko-metalurški fakultet Univerziteta u Beogradu, Beograd 1 Uredba o granicnim vrednostima emisije
Primena instrumentalnih metoda na analizu uzoraka vode Zoran Simi ć, master inženjer tehnologije Tehnološko-metalurški fakultet Univerziteta u Beogradu, Beograd 1 Uredba o granicnim vrednostima emisije
Weishaupt monarch (WM) serija
 Gorionici - uštede energije primenom O2 i frekventne regulacije Emisije štetnih materija u produktima sagorevanja Budva, 23.09.2016. Gorionici Uštede energije O 2 regulacija ušteda minimum 2% goriva vraćanje
Gorionici - uštede energije primenom O2 i frekventne regulacije Emisije štetnih materija u produktima sagorevanja Budva, 23.09.2016. Gorionici Uštede energije O 2 regulacija ušteda minimum 2% goriva vraćanje
Microsoft Word - VIII_P2_za_eskolu.doc
 POSEBNA NAPOMENA: Ispravljanje i bodovanje učeničkih odgovora u ovom pokusu provedeno je na specifičan način s obzirom da su neka pitanja ispitivala sposobnost primjene usvojenog znanja u neuobičajenim
POSEBNA NAPOMENA: Ispravljanje i bodovanje učeničkih odgovora u ovom pokusu provedeno je na specifičan način s obzirom da su neka pitanja ispitivala sposobnost primjene usvojenog znanja u neuobičajenim
OD MONOKRISTALNIH ELEKTRODA DO MODELÂ POVRŠINSKIH REAKCIJA
 UVOD U PRAKTIKUM FIZIKALNE KEMIJE TIN KLAČIĆ, mag. chem. Zavod za fizikalnu kemiju, 2. kat (soba 219) Kemijski odsjek Prirodoslovno-matematički fakultet Sveučilište u Zagrebu e-mail: tklacic@chem.pmf.hr
UVOD U PRAKTIKUM FIZIKALNE KEMIJE TIN KLAČIĆ, mag. chem. Zavod za fizikalnu kemiju, 2. kat (soba 219) Kemijski odsjek Prirodoslovno-matematički fakultet Sveučilište u Zagrebu e-mail: tklacic@chem.pmf.hr
Slide 1
 Utjecaj ciljane gnojidbe na povećanje randmana i kvalitativna svojstva maslinovog ulja. 4. FESTIVAL MASLINA Zagreb, 23.-24. veljače 2019. Autorica: mr.sc. Sanja Biškup MINERALNA GNOJIVA nastaju od prirodnih
Utjecaj ciljane gnojidbe na povećanje randmana i kvalitativna svojstva maslinovog ulja. 4. FESTIVAL MASLINA Zagreb, 23.-24. veljače 2019. Autorica: mr.sc. Sanja Biškup MINERALNA GNOJIVA nastaju od prirodnih
MEDICINSKI FAKULTET SVEUČILIŠTA U MOSTARU DIPLOMSKI SVEUČILIŠNI STUDIJ MEDICINE Kolegij: Medicinska kemija Nositeljica kolegija: prof. dr. sc. Zora Pi
 MEDICINSKI FAKULTET SVEUČILIŠTA U MOSTARU DIPLOMSKI SVEUČILIŠNI STUDIJ MEDICINE Kolegij: Medicinska kemija Nositeljica kolegija: prof. dr. sc. Zora Pilić Godina: I Semestar: II ECTS Razina kolegija: Osnovna
MEDICINSKI FAKULTET SVEUČILIŠTA U MOSTARU DIPLOMSKI SVEUČILIŠNI STUDIJ MEDICINE Kolegij: Medicinska kemija Nositeljica kolegija: prof. dr. sc. Zora Pilić Godina: I Semestar: II ECTS Razina kolegija: Osnovna
ALKOHOLI
 ALKLI Hidroksilna grupa vezana na zasićeni sp 3 hibridizirani C-atom C C C Alkohol Fenol Enol Alkoholi u prirodi CH 3 CH 3 CH 2 Etanol CH3 Metanol CH 3 CH 3 Mentol (iz pepermint ulja) Izoprenska jedinica
ALKLI Hidroksilna grupa vezana na zasićeni sp 3 hibridizirani C-atom C C C Alkohol Fenol Enol Alkoholi u prirodi CH 3 CH 3 CH 2 Etanol CH3 Metanol CH 3 CH 3 Mentol (iz pepermint ulja) Izoprenska jedinica
MergedFile
 27. јун 2019. Тест из ХЕМИЈЕ Група: A Тест из ХЕМИЈЕ има 15 питања на 4 стране. Сва питања вреде по 2 поена. Нема негативних поена. NA = 6 10 23 mol -1 ; Vm = 22,4 dm 3 mol -1 ; Ar: H-1; Na-23; O-16; S-32;
27. јун 2019. Тест из ХЕМИЈЕ Група: A Тест из ХЕМИЈЕ има 15 питања на 4 стране. Сва питања вреде по 2 поена. Нема негативних поена. NA = 6 10 23 mol -1 ; Vm = 22,4 dm 3 mol -1 ; Ar: H-1; Na-23; O-16; S-32;
Microsoft PowerPoint - Prvi tjedan [Compatibility Mode]
![Microsoft PowerPoint - Prvi tjedan [Compatibility Mode] Microsoft PowerPoint - Prvi tjedan [Compatibility Mode]](/thumbs/99/139589070.jpg) REAKTORI I BIOREAKTORI PODJELA I OSNOVNI TIPOVI KEMIJSKIH REAKTORA Vanja Kosar, izv. prof. KEMIJSKI REAKTOR I KEMIJSKO RAKCIJSKO INŽENJERSTVO PODJELA REAKTORA I OPĆE BILANCE TVARI i TOPLINE 2 Kemijski
REAKTORI I BIOREAKTORI PODJELA I OSNOVNI TIPOVI KEMIJSKIH REAKTORA Vanja Kosar, izv. prof. KEMIJSKI REAKTOR I KEMIJSKO RAKCIJSKO INŽENJERSTVO PODJELA REAKTORA I OPĆE BILANCE TVARI i TOPLINE 2 Kemijski
Microsoft PowerPoint - SSA_seminar_1_dio [Compatibility Mode]
![Microsoft PowerPoint - SSA_seminar_1_dio [Compatibility Mode] Microsoft PowerPoint - SSA_seminar_1_dio [Compatibility Mode]](/thumbs/100/146475485.jpg) Spektroskopska k k strukturna analiza seminar 1dio 1. nositelj: prof. dr. sc. Predrag Novak održao i sastavio: doc. dr. sc. Tomislav Jednačak; ak. god. 2018./19. Područja kemijskog pomaka signala u 1 H
Spektroskopska k k strukturna analiza seminar 1dio 1. nositelj: prof. dr. sc. Predrag Novak održao i sastavio: doc. dr. sc. Tomislav Jednačak; ak. god. 2018./19. Područja kemijskog pomaka signala u 1 H
NEURONAL
 NEW IRON PROIZVODI : MEDICINALIS D.O.O. ODGOVORAN ZA RH : D.O.O. NEW IRON SASTOJCI PROIZVODI : MEDICINALIS D.O.O. ODGOVORAN ZA RH : D.O.O. KELATI (prema grč. pandža) Kelati su kompleksni spojevi u kojima
NEW IRON PROIZVODI : MEDICINALIS D.O.O. ODGOVORAN ZA RH : D.O.O. NEW IRON SASTOJCI PROIZVODI : MEDICINALIS D.O.O. ODGOVORAN ZA RH : D.O.O. KELATI (prema grč. pandža) Kelati su kompleksni spojevi u kojima
ALKALITET VODE (p i m-vrijednost) Ukupnu tvrdoću sačinjavaju sve kalcijeve i magnezijeve soli sadržane u vodi u obliku karbonata, hidrogenkarbonata, k
 ALKALITET VODE (p i m-vrijednost) Ukupnu tvrdoću sačinjavaju sve kalcijeve i magnezijeve soli sadržane u vodi u obliku karbonata, hidrogenkarbonata, klorida, sulfata, nitrata, silikata, fosfata i dr. Iz
ALKALITET VODE (p i m-vrijednost) Ukupnu tvrdoću sačinjavaju sve kalcijeve i magnezijeve soli sadržane u vodi u obliku karbonata, hidrogenkarbonata, klorida, sulfata, nitrata, silikata, fosfata i dr. Iz
Microsoft PowerPoint - 3_Elektrohemijska_korozija_kinetika.ppt - Compatibility Mode
 KOROZIJA I ZAŠTITA METALA dr Aleksandar Lj. Bojić Elektrohemijska korozija Kinetika korozionog procesa 1 Korozioni sistem izvan stanja ravnoteže polarizacija Korozija metala: istovremeno odvijanje dve
KOROZIJA I ZAŠTITA METALA dr Aleksandar Lj. Bojić Elektrohemijska korozija Kinetika korozionog procesa 1 Korozioni sistem izvan stanja ravnoteže polarizacija Korozija metala: istovremeno odvijanje dve
Прилог 7. Граничне вредности концентрације опасних компоненти у отпаду на основу којих се одређују карактеристике отпада (својства отпада која га кара
 Прилог 7. Граничне вредности концентрације опасних компоненти у отпаду на основу којих се одређују карактеристике отпада (својства отпада која га карактеришу као опасан отпад) H1 Експлозиван : Отпад класификован
Прилог 7. Граничне вредности концентрације опасних компоненти у отпаду на основу којих се одређују карактеристике отпада (својства отпада која га карактеришу као опасан отпад) H1 Експлозиван : Отпад класификован
Microsoft PowerPoint - 4_Hemijska_korozija.ppt - Compatibility Mode
 KOROZIJA I ZAŠTITA METALA dr Aleksandar Lj. Bojić Hemijska korozija metala 1 Hemijska korozija: proces reagovanja metalne površine sa okolinom, kod koga je prelaz metala u jonsko stanje i redukcija oksidacione
KOROZIJA I ZAŠTITA METALA dr Aleksandar Lj. Bojić Hemijska korozija metala 1 Hemijska korozija: proces reagovanja metalne površine sa okolinom, kod koga je prelaz metala u jonsko stanje i redukcija oksidacione
Toplinska i električna vodljivost metala
 Električna vodljivost metala Cilj vježbe Određivanje koeficijenta električne vodljivosti bakra i aluminija U-I metodom. Teorijski dio Eksperimentalno je utvrđeno da otpor ne-ohmskog vodiča raste s porastom
Električna vodljivost metala Cilj vježbe Određivanje koeficijenta električne vodljivosti bakra i aluminija U-I metodom. Teorijski dio Eksperimentalno je utvrđeno da otpor ne-ohmskog vodiča raste s porastom
Narodne novine, broj 162/98. i 107/07. ZAKON O LISTI PROFESIONALNIH BOLESTI (neslužbeno pročišćeni tekst) Članak 1. Ovim se Zakonom utvrđuju bolesti k
 Narodne novine, broj 162/98. i 107/07. ZAKON O LISTI PROFESIONALNIH BOLESTI (neslužbeno pročišćeni tekst) Članak 1. Ovim se Zakonom utvrđuju bolesti koje se, prema članku 38. stavku 1. Zakona o mirovinskom
Narodne novine, broj 162/98. i 107/07. ZAKON O LISTI PROFESIONALNIH BOLESTI (neslužbeno pročišćeni tekst) Članak 1. Ovim se Zakonom utvrđuju bolesti koje se, prema članku 38. stavku 1. Zakona o mirovinskom
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEM
 Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učeni(ka)ca osnovnih i srednjih škola 2013. PISANA
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učeni(ka)ca osnovnih i srednjih škola 2013. PISANA
Geometrija molekula
 Geometrija molekula Oblik molekula predstavlja trodimenzionalni raspored atoma u okviru molekula. Geometrija molekula je veoma važan faktor koji određuje fizička i hemijska svojstva nekog jedinjenja, kao
Geometrija molekula Oblik molekula predstavlja trodimenzionalni raspored atoma u okviru molekula. Geometrija molekula je veoma važan faktor koji određuje fizička i hemijska svojstva nekog jedinjenja, kao
OKFH2-10
 KOLOIDI DISPERZNI SISTEMI Disperzni sistemi sistemi u kojima je jedna ili više supstancija (disperzna faza) u većoj ili manjoj meri usitnjena i ravnomerno raspoređena u okružujućoj sredini (disperzno sredstvo).
KOLOIDI DISPERZNI SISTEMI Disperzni sistemi sistemi u kojima je jedna ili više supstancija (disperzna faza) u većoj ili manjoj meri usitnjena i ravnomerno raspoređena u okružujućoj sredini (disperzno sredstvo).
Microsoft PowerPoint - 14obk-s11a-uvod u metabolizam
 Seminar 11a Uvod u metabolizam Boris Mildner Rješenja zadaće 10. 1. D 11. D 2. B 12. B 3. B 13. C 4. A 14. A 5. A 15. B 6. B 16. B 7. D 17. D 8. A 18. B 9. C 19. D 10. B 20. D 1 1. Koji enzim u želucu
Seminar 11a Uvod u metabolizam Boris Mildner Rješenja zadaće 10. 1. D 11. D 2. B 12. B 3. B 13. C 4. A 14. A 5. A 15. B 6. B 16. B 7. D 17. D 8. A 18. B 9. C 19. D 10. B 20. D 1 1. Koji enzim u želucu
KARBOKSILNE KISELINE
 Najvažnije nezasićene dikarbonske kiseline su maleinska i fumarna kiselina kao klasični primjeri geometrijske izomerije tzv. cis- i transizomerija: H C HC C H H C H C cis-maleinska kiselina trans-fumarna
Najvažnije nezasićene dikarbonske kiseline su maleinska i fumarna kiselina kao klasični primjeri geometrijske izomerije tzv. cis- i transizomerija: H C HC C H H C H C cis-maleinska kiselina trans-fumarna
PARCIJALNO MOLARNE VELIČINE
 PARCIJALNE MOLARNE VELIČINE ZATVOREN TERMODINAMIČKI SISTEM-konstantan sastav sistema Posmatra se neka termodinamička ekstenzivna veličina X X (V, U, H, G, A, S) X je u funkciji bilo kog para intenzivnih
PARCIJALNE MOLARNE VELIČINE ZATVOREN TERMODINAMIČKI SISTEM-konstantan sastav sistema Posmatra se neka termodinamička ekstenzivna veličina X X (V, U, H, G, A, S) X je u funkciji bilo kog para intenzivnih
Microsoft Word - Molekuli-zadaci.doc
 Задаци Други колоквијум - Молекулски спектри Пример 1 Израчунајте апсорбанцију раствора, ако је познато да је транспаренција 89% на 00 nm. А 0,071 λ 00 nm таласна дужина на којој је мерена апсорбанција
Задаци Други колоквијум - Молекулски спектри Пример 1 Израчунајте апсорбанцију раствора, ако је познато да је транспаренција 89% на 00 nm. А 0,071 λ 00 nm таласна дужина на којој је мерена апсорбанција
ENERGETSKI_SUSTAVI_P11_Energetski_sustavi_dizalice_topline_2
 ENERGETSKI SUSTAVI DIZALICE TOPLINE (Toplinske pumpe) ENERGETSKI TOK ZA DIZALICE TOPLINE (TOPLINSKE PUMPE) ENERGETSKI SUSTAVI 2 DIZALICE TOPLINE (TOPLINSKE PUMPE) DIZALICE TOPLINE koriste se za prijenos
ENERGETSKI SUSTAVI DIZALICE TOPLINE (Toplinske pumpe) ENERGETSKI TOK ZA DIZALICE TOPLINE (TOPLINSKE PUMPE) ENERGETSKI SUSTAVI 2 DIZALICE TOPLINE (TOPLINSKE PUMPE) DIZALICE TOPLINE koriste se za prijenos
Title Layout
 Optimizacija hidrotermalne metode za sintezu trostrukih perovskita tipa Sr 3 Mn 2 (W/Te)O 9 The Optimization of Hydrothermal Method for the Synthesis of Triple Perovskites with a Sr 3 Mn 2 (W/Te)O 9 Structure
Optimizacija hidrotermalne metode za sintezu trostrukih perovskita tipa Sr 3 Mn 2 (W/Te)O 9 The Optimization of Hydrothermal Method for the Synthesis of Triple Perovskites with a Sr 3 Mn 2 (W/Te)O 9 Structure
Правилник o допунама Правилника о ограничењима и забранама производње, стављања у промет и коришћења хемикалија Члан 1. У Правилнику о ограничењима и
 Правилник o допунама Правилника о ограничењима и забранама производње, стављања у промет и коришћења хемикалија Члан 1. У Правилнику о ограничењима и забранама производње, стављања у промет и коришћења
Правилник o допунама Правилника о ограничењима и забранама производње, стављања у промет и коришћења хемикалија Члан 1. У Правилнику о ограничењима и забранама производње, стављања у промет и коришћења
Факултет педагошких наука Универзитета у Крагујевцу, Јагодина Весна Трифуновић ПРАКТИКУМ ИЗ СОЦИОЛОГИЈЕ ОБРАЗОВАЊА Јагодина 2018
 Факултет педагошких наука Универзитета у Крагујевцу, Јагодина Весна Трифуновић ПРАКТИКУМ ИЗ СОЦИОЛОГИЈЕ ОБРАЗОВАЊА Јагодина 2018 Издавач Факултет педагошких наука Универзитета у Крагујевцу Милана Мијалковића
Факултет педагошких наука Универзитета у Крагујевцу, Јагодина Весна Трифуновић ПРАКТИКУМ ИЗ СОЦИОЛОГИЈЕ ОБРАЗОВАЊА Јагодина 2018 Издавач Факултет педагошких наука Универзитета у Крагујевцу Милана Мијалковића
Napomena: Radni spisak je smernica za lakše povezivanje propisa kojim se uređuje promet lekova i medicinskih sredstava sa Nomenklaturom CT i podložan
 Списак супстанци за производњу и промет лекова и, за чији увоз/извоз је потребно прибавити дозволу за производњу лека/медицинског средства на велико или дозволу за промет лека/медицинског средства на велико,
Списак супстанци за производњу и промет лекова и, за чији увоз/извоз је потребно прибавити дозволу за производњу лека/медицинског средства на велико или дозволу за промет лека/медицинског средства на велико,
Microsoft PowerPoint - 08_Halogeni elementi [Compatibility Mode]
![Microsoft PowerPoint - 08_Halogeni elementi [Compatibility Mode] Microsoft PowerPoint - 08_Halogeni elementi [Compatibility Mode]](/thumbs/102/153188708.jpg) 17. grupa Periodnog sistema elemenata. Zajednički simbol X. Ne nalaze se u prirodi u elementarnom stanju (zbog velike reaktivnosti), već u obliku: F minerala fluorita (CaF 2 ) Cl minerala halita (NaCl)
17. grupa Periodnog sistema elemenata. Zajednički simbol X. Ne nalaze se u prirodi u elementarnom stanju (zbog velike reaktivnosti), već u obliku: F minerala fluorita (CaF 2 ) Cl minerala halita (NaCl)
Slide 1
 Kompleksi Prelazni metali Međusobno imaju slične osobine Dosta se razlikuju od alkalih i zemnoalkalnih metala Imaju visoku tačku topljenja,veliku gustinu, uglavnom veliku tvrdoću, dobri su provodnici
Kompleksi Prelazni metali Međusobno imaju slične osobine Dosta se razlikuju od alkalih i zemnoalkalnih metala Imaju visoku tačku topljenja,veliku gustinu, uglavnom veliku tvrdoću, dobri su provodnici
БИОНЕОРГАНСКА ХЕМИЈА ИНТЕГРИСАНЕ АКАДЕМСКЕ СТУДИЈЕ ФАРМАЦИЈЕ ТРЕЋА ГОДИНА СТУДИЈА школска 2018/2019.
 БИОНЕОРГАНСКА ХЕМИЈА ИНТЕГРИСАНЕ АКАДЕМСКЕ СТУДИЈЕ ФАРМАЦИЈЕ ТРЕЋА ГОДИНА СТУДИЈА школска 2018/2019. Предмет: БИОНЕОРГАНСКА ХЕМИЈА Предмет се вреднује са 7 ЕСПБ. Недељно има 5 часова активне наставе (2
БИОНЕОРГАНСКА ХЕМИЈА ИНТЕГРИСАНЕ АКАДЕМСКЕ СТУДИЈЕ ФАРМАЦИЈЕ ТРЕЋА ГОДИНА СТУДИЈА школска 2018/2019. Предмет: БИОНЕОРГАНСКА ХЕМИЈА Предмет се вреднује са 7 ЕСПБ. Недељно има 5 часова активне наставе (2
РЕПУБЛИКА СРБИЈА ЗАВОД ЗА ЈАВНО ЗДРАВЉЕ ПОЖАРЕВАЦ Јована Шербановића 14, Пожаревац Web: E- mail: Тел.: 012/222-
 ЦЕНТАР ЗА ХИГИЈЕНУ И ХУМАНУ ЕКОЛОГИЈУ ИЗВЕШТАЈ О КОНТРОЛИ КВАЛИТЕТА ВАЗДУХА У СМЕДЕРЕВУ У 2017. ГОДИНИ јануар 2018 УВОД Завод за јавно здравље Пожаревац је на захтев Министарства заштите животне средине
ЦЕНТАР ЗА ХИГИЈЕНУ И ХУМАНУ ЕКОЛОГИЈУ ИЗВЕШТАЈ О КОНТРОЛИ КВАЛИТЕТА ВАЗДУХА У СМЕДЕРЕВУ У 2017. ГОДИНИ јануар 2018 УВОД Завод за јавно здравље Пожаревац је на захтев Министарства заштите животне средине
Универзитет у Београду Хемијски факултет Наставно-научном већу Хемијског факултета Предмет: Извештај Комисије за преглед и оцену докторске дисертације
 Универзитет у Београду Хемијски факултет Наставно-научном већу Хемијског факултета Предмет: Извештај Комисије за преглед и оцену докторске дисертације Нине С. Божиновић, асистента запосленог на Хемијском
Универзитет у Београду Хемијски факултет Наставно-научном већу Хемијског факултета Предмет: Извештај Комисије за преглед и оцену докторске дисертације Нине С. Божиновић, асистента запосленог на Хемијском
Kvalitet voda 2012
 Назив реке - ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА Шифра станице - 7805 7805 7805 7805 7805 7805 7805 7805 7805 7805 7805 7805 Ознака места узорковања - A1
Назив реке - ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА ЂЕТИЊА Шифра станице - 7805 7805 7805 7805 7805 7805 7805 7805 7805 7805 7805 7805 Ознака места узорковања - A1
LAB PRAKTIKUM OR1 _ETR_
 UNIVERZITET CRNE GORE ELEKTROTEHNIČKI FAKULTET STUDIJSKI PROGRAM: ELEKTRONIKA, TELEKOMUNIKACIJE I RAČUNARI PREDMET: OSNOVE RAČUNARSTVA 1 FOND ČASOVA: 2+1+1 LABORATORIJSKA VJEŽBA BROJ 1 NAZIV: REALIZACIJA
UNIVERZITET CRNE GORE ELEKTROTEHNIČKI FAKULTET STUDIJSKI PROGRAM: ELEKTRONIKA, TELEKOMUNIKACIJE I RAČUNARI PREDMET: OSNOVE RAČUNARSTVA 1 FOND ČASOVA: 2+1+1 LABORATORIJSKA VJEŽBA BROJ 1 NAZIV: REALIZACIJA
CVRSTOCA
 ČVRSTOĆA 12 TEORIJE ČVRSTOĆE NAPREGNUTO STANJE Pri analizi unutarnjih sila koje se pojavljuju u kosom presjeku štapa opterećenog na vlak ili tlak, pri jednoosnom napregnutom stanju, u tim presjecima istodobno
ČVRSTOĆA 12 TEORIJE ČVRSTOĆE NAPREGNUTO STANJE Pri analizi unutarnjih sila koje se pojavljuju u kosom presjeku štapa opterećenog na vlak ili tlak, pri jednoosnom napregnutom stanju, u tim presjecima istodobno
ANALITIČKA KEMIJA SEMINAR
 SMINAR IZ KOLGIJA ANALITIČKA KMIJA I Studij Primijenjena kemija 1. Izračunajte potenijale sistema H AsO H AsO pri ph 1 i ph 6 u trenutku kada su konentraije oksidiranog i reduiranog oblika izjednačene!
SMINAR IZ KOLGIJA ANALITIČKA KMIJA I Studij Primijenjena kemija 1. Izračunajte potenijale sistema H AsO H AsO pri ph 1 i ph 6 u trenutku kada su konentraije oksidiranog i reduiranog oblika izjednačene!
ДРУШТВО ФИЗИЧАРА СРБИЈЕ МИНИСТАРСТВО ПРОСВЕТЕ И СПОРТА РЕПУБЛИКЕ СРБИЈЕ Задаци за републичко такмичење ученика средњих школа 2006/2007 године I разред
 ДРУШТВО ФИЗИЧАРА СРБИЈЕ МИНИСТАРСТВО ПРОСВЕТЕ И СПОРТА РЕПУБЛИКЕ СРБИЈЕ Задаци за републичко такмичење ученика средњих школа 006/007 године разред. Електрични систем се састоји из отпорника повезаних тако
ДРУШТВО ФИЗИЧАРА СРБИЈЕ МИНИСТАРСТВО ПРОСВЕТЕ И СПОРТА РЕПУБЛИКЕ СРБИЈЕ Задаци за републичко такмичење ученика средњих школа 006/007 године разред. Електрични систем се састоји из отпорника повезаних тако
505
 505. На основу члана 11 став 3 Закона о заштити ваздуха ( Службени лист ЦГ", број 25/10), Влада Црне Горе на сједници од 8.јула 2010. године, донијела је УРЕДБУ О УСПОСТАВЉАЊУ МРЕЖЕ МЈЕРНИХ МЈЕСТА ЗА ПРАЋЕЊЕ
505. На основу члана 11 став 3 Закона о заштити ваздуха ( Службени лист ЦГ", број 25/10), Влада Црне Горе на сједници од 8.јула 2010. године, донијела је УРЕДБУ О УСПОСТАВЉАЊУ МРЕЖЕ МЈЕРНИХ МЈЕСТА ЗА ПРАЋЕЊЕ
MINISTARSTVO ZAŠTITE OKOLIŠA I PRIRODE 1746 Na temelju članka 29. stavka 2. Zakona o zaštiti zraka (»Narodne novine«, br. 130/2011, 47/2014), ministar
 INISTARSTVO ZAŠTITE OKOLIŠA I PRIRODE 1746 Na temelju članka 29. stavka 2. Zakona o zaštiti zraka (»Narodne novine«, br. 130/2011, 47/2014), ministar zaštite okoliša i prirode donosi PROGRA JERENJA RAZINE
INISTARSTVO ZAŠTITE OKOLIŠA I PRIRODE 1746 Na temelju članka 29. stavka 2. Zakona o zaštiti zraka (»Narodne novine«, br. 130/2011, 47/2014), ministar zaštite okoliša i prirode donosi PROGRA JERENJA RAZINE
OZNAKE UPOZORENJA NA BOCAMA SA HEMIKALIJAMA eksplozivan oksidant korozivan štetan iritantan toksičan ekstremno toksičan zapaljiv ekstremno zapaljiv št
 ZNAKE UPZRENJA NA BCAMA SA HEMIKALIJAMA eksplozivan oksidant korozivan štetan iritantan toksičan ekstremno toksičan zapaljiv ekstremno zapaljiv štetan po okolinu ZAŠTITA PRI RADU U LABRATRIJI zaštita lica
ZNAKE UPZRENJA NA BCAMA SA HEMIKALIJAMA eksplozivan oksidant korozivan štetan iritantan toksičan ekstremno toksičan zapaljiv ekstremno zapaljiv štetan po okolinu ZAŠTITA PRI RADU U LABRATRIJI zaštita lica
МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА РЕПУБЛИКЕ СРБИЈЕ ЗАВОД ЗА УНАПРЕЂИВАЊE ОБРАЗОВАЊА И ВАСПИТАЊА Пословно удружење средњих стручних шк
 МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА РЕПУБЛИКЕ СРБИЈЕ ЗАВОД ЗА УНАПРЕЂИВАЊE ОБРАЗОВАЊА И ВАСПИТАЊА Пословно удружење средњих стручних школа Републике Србије за подручје рада Хемија, неметали
МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА РЕПУБЛИКЕ СРБИЈЕ ЗАВОД ЗА УНАПРЕЂИВАЊE ОБРАЗОВАЊА И ВАСПИТАЊА Пословно удружење средњих стручних школа Републике Србије за подручје рада Хемија, неметали
Sveučilište J.J. Strossmayera Fizika 2 FERIT Predložak za laboratorijske vježbe Određivanje relativne permitivnosti sredstva Cilj vježbe Određivanje r
 Sveučilište J.J. Strossmayera Fizika 2 Predložak za laboratorijske vježbe Cilj vježbe Određivanje relativne permitivnosti stakla, plastike, papira i zraka mjerenjem kapaciteta pločastog kondenzatora U-I
Sveučilište J.J. Strossmayera Fizika 2 Predložak za laboratorijske vježbe Cilj vježbe Određivanje relativne permitivnosti stakla, plastike, papira i zraka mjerenjem kapaciteta pločastog kondenzatora U-I
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa
 Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učeni(ka)ca osnovnih i srednjih škola 2011. PISANA
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učeni(ka)ca osnovnih i srednjih škola 2011. PISANA
Elektronika 1 udzb.indb
 t.h r Poluvodička dioda.e le m Poluvodiči Poluvodička dioda Neke vrste dioda Sklopovi s diodama w 1.1. 1.2. 1.3. 1.4. en t.h r w w w.e le m en 1. 1. Poluvodička dioda Slika 1.1. Silicij Slika 1.2. Germanij
t.h r Poluvodička dioda.e le m Poluvodiči Poluvodička dioda Neke vrste dioda Sklopovi s diodama w 1.1. 1.2. 1.3. 1.4. en t.h r w w w.e le m en 1. 1. Poluvodička dioda Slika 1.1. Silicij Slika 1.2. Germanij
Kvadrupolni maseni analizator, princip i primena u kvali/kvanti hromatografiji
 Kvadrupolni maseni analizator, princip i primena u kvali/kvanti hromatografiji doc dr Nenad Vuković, Institut za hemiju, Prirodno-matematički fakultet u Kragujevcu JONIZACIJA ELEKTRONSKIM UDAROM Joni u
Kvadrupolni maseni analizator, princip i primena u kvali/kvanti hromatografiji doc dr Nenad Vuković, Institut za hemiju, Prirodno-matematički fakultet u Kragujevcu JONIZACIJA ELEKTRONSKIM UDAROM Joni u
Polihlorovani bifenili PCB je dobro poznata skraćenica za polihlorovane bifenile, grupu industriskih ograno-hlornih jedinjenja velikih zagađivača 80
 11. Hemodinamika polihlorovanih bifenila, dioksina i furana Polihlorovani bifenili PCB je skraćenica za polihlorovane bifenile, grupu industrijskih ogranohlornih jedinjenja koje su se javile 80-tih i 90-
11. Hemodinamika polihlorovanih bifenila, dioksina i furana Polihlorovani bifenili PCB je skraćenica za polihlorovane bifenile, grupu industrijskih ogranohlornih jedinjenja koje su se javile 80-tih i 90-
Oksidacijska desulfurizacija... R. Joskić, D. Margeta, K. Setić Bionda Robert Joskić, Dunja Margeta, Katica Sertić-Bionda ISSN X GOMABN 53, 1,
 Robert Joskić, Dunja Margeta, Katica Sertić-Bionda ISSN 0350-350X GOMABN 53, 1, 2-10 Izvorni znanstveni rad / Original scientific paper OKSIDACIJSKA DESULFURIZACIJA MODELNOG DIZELSKOG GORIVA VODIKOVIM
Robert Joskić, Dunja Margeta, Katica Sertić-Bionda ISSN 0350-350X GOMABN 53, 1, 2-10 Izvorni znanstveni rad / Original scientific paper OKSIDACIJSKA DESULFURIZACIJA MODELNOG DIZELSKOG GORIVA VODIKOVIM
OBIM AKREDITACIJE
 АКРЕДИТАЦИОНО ТЕЛО СРБИЈЕ : Датум прве акредитације/ Date of initial accreditation: 05.11.2010. Ознака предмета/file Ref. No.: 2-01-384 Важи од/ Valid from: Замењује Обим од: Replaces Scope dated: ОБИМ
АКРЕДИТАЦИОНО ТЕЛО СРБИЈЕ : Датум прве акредитације/ Date of initial accreditation: 05.11.2010. Ознака предмета/file Ref. No.: 2-01-384 Важи од/ Valid from: Замењује Обим од: Replaces Scope dated: ОБИМ
PowerPoint Presentation
 Prečišćavanje otpadnih gasova Pregled SISTEMI ZA PREČIŠĆAVANJE OTPADNIH GASOVA SISTEMI ZA UKLANJANJE ČESTICA SISTEMI ZA UKLANJANJE GASOVITIH POLUTANATA 10 Emisija u svetu (Mt/god) CO VOCs SOx NOx ČESTICE
Prečišćavanje otpadnih gasova Pregled SISTEMI ZA PREČIŠĆAVANJE OTPADNIH GASOVA SISTEMI ZA UKLANJANJE ČESTICA SISTEMI ZA UKLANJANJE GASOVITIH POLUTANATA 10 Emisija u svetu (Mt/god) CO VOCs SOx NOx ČESTICE
Proteini
 PROTEINI 1 PROTEINI Proteini su najkompleksnija i najraznolikija klasa molekula nađenih u živim organizmima. 1838 - Danski biohemičar G.J. Mulder dao naziv proteini - od primarne važnosti. 2 Svi proteini
PROTEINI 1 PROTEINI Proteini su najkompleksnija i najraznolikija klasa molekula nađenih u živim organizmima. 1838 - Danski biohemičar G.J. Mulder dao naziv proteini - od primarne važnosti. 2 Svi proteini
BS-predavanje-3-plinovi-krutine-tekucine
 STRUKTURA ČISTIH TVARI Pojam temperature Porastom temperature raste brzina gibanja plina, osciliranje atoma i molekula u kristalu i tekućini Temperatura izražava intenzivnost gibanja atoma i molekula u
STRUKTURA ČISTIH TVARI Pojam temperature Porastom temperature raste brzina gibanja plina, osciliranje atoma i molekula u kristalu i tekućini Temperatura izražava intenzivnost gibanja atoma i molekula u
1 Прилог 5. Назив факултета који подноси захтев: Факултет за физичку хемију Универзитет у Београду Студентски трг 12-16, Београд РЕЗИМЕ ИЗВЕШТАЈ
 1 Прилог 5. Назив факултета који подноси захтев: Факултет за физичку хемију Студентски трг 12-16, 11158 Београд РЕЗИМЕ ИЗВЕШТАЈА О КАНДИДАТУ ЗА СТИЦАЊЕ НАУЧНОГ ЗВАЊА I Општи подаци о кандидату Име и презиме:
1 Прилог 5. Назив факултета који подноси захтев: Факултет за физичку хемију Студентски трг 12-16, 11158 Београд РЕЗИМЕ ИЗВЕШТАЈА О КАНДИДАТУ ЗА СТИЦАЊЕ НАУЧНОГ ЗВАЊА I Општи подаци о кандидату Име и презиме:
Хемијски састав ћелије *Подсетник Хемијски елемент је супстанца која се, хемијском реакцијом, не може претворити удругу супстанцу. Најмањи део хемијск
 Хемијски састав ћелије *Подсетник Хемијски елемент је супстанца која се, хемијском реакцијом, не може претворити удругу супстанцу. Најмањи део хемијског елемента који задржава његове особине је атом. Хемијско
Хемијски састав ћелије *Подсетник Хемијски елемент је супстанца која се, хемијском реакцијом, не може претворити удругу супстанцу. Најмањи део хемијског елемента који задржава његове особине је атом. Хемијско
Sveučilište J.J. Strossmayera Fizika 2 FERIT Predložak za laboratorijske vježbe Cilj vježbe Određivanje specifičnog naboja elektrona Odrediti specifič
 Cilj vježbe Određivanje specifičnog naboja elektrona Odrediti specifični naboja elektrona (omjer e/me) iz poznatog polumjera putanje elektronske zrake u elektronskoj cijevi, i poznatog napona i jakosti
Cilj vježbe Određivanje specifičnog naboja elektrona Odrediti specifični naboja elektrona (omjer e/me) iz poznatog polumjera putanje elektronske zrake u elektronskoj cijevi, i poznatog napona i jakosti
Microsoft Word - PRIJEMNI EKOLOGIJA 2013_2.doc
 Универзитет у Бањој Луци Бања Лука 2013.г. ОЈ Природно-математички факултет Студијски програм Екологија и заштита животне средине Име и презиме кандидата: ПРИЈЕМНИ ИСПИТ БИОЛОГИЈА Заокружите слово испред
Универзитет у Бањој Луци Бања Лука 2013.г. ОЈ Природно-математички факултет Студијски програм Екологија и заштита животне средине Име и презиме кандидата: ПРИЈЕМНИ ИСПИТ БИОЛОГИЈА Заокружите слово испред
Microsoft Word - Vezba 3_Stilometrija-uputstvo za vezbu (Repaired).doc
 СПЕКТРОСКОПСКО ОДРЕЂИВАЊЕ САСТАВА ЛЕГУРЕ Табела 1: Области таласних дужина у видљивом делу спектра за сваку боју појединачно Боја Област таласних дужина nm Љубичаста 400 420 Индиго 420 440 Плава 440 490
СПЕКТРОСКОПСКО ОДРЕЂИВАЊЕ САСТАВА ЛЕГУРЕ Табела 1: Области таласних дужина у видљивом делу спектра за сваку боју појединачно Боја Област таласних дужина nm Љубичаста 400 420 Индиго 420 440 Плава 440 490
