KERAM IKA-KETONI 75 pri norm alnoj okolnoj tem peraturi tako krhka da se lome i pri vrlo slabom udarcu. Metalokeramika je posebna grana keramike. O na
|
|
|
- Irma Milosavljević
- пре 5 година
- Прикази:
Транскрипт
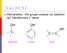
1 KEAM KA-KETON 75 pri norm alnoj okolnoj tem peraturi tako krhka da se lome i pri vrlo slabom udaru. Metalokeramika je posebna grana keramike. O na obuhvaća postupke za izradbu predm eta od m etala koji imaju vrlo visoku tem peraturu taljenja, što otežava njihovu obradbu. Prešanjem takvih m aterijala u praškastom stanju i naknadnim sinteriranjem postižu se izvanredna svojstva proizvoda. Ta je grana keramike postala prijeko potrebna za izradbu niza proizvoda na bazi volframa, molibdena i tantala. Lijevanje takvih m etala nije moguće, jer žestoko reagiraju s m aterijalom tignjeva za lijevanje. Lijevanjem, osim toga, ne mogu se dobiti porozni proizvodi, a prilikom lijevanja metal se ne može održati čistim jer se legira s drugim materijalima. K ao sirovine obično se upotrebljavaju metalni oksidi ili hidroksidi u obliku prašine. Sirovine m oraju imati mali koefiijent toplinskog rastezanja, pa se zbog toga karbonati i sirovine koje sadrže vodu m oraju prije toga peći. Sirovine se m oraju vrlo fino usitniti. K ako su metalne sirovine obično žilave, teško se melju u kugličnim mlinovima, pa se usitnjuju posebnim postupima. Prešaju se u m atriam a pod tlakom od 100* 1000 M Pa. Zbog toga alati m oraju biti izrađeni od najkvalitetnijeg čelika. M etalna se prašina pod tako visokim tlakom fino pakuje i tvori čvrste otpreske, što je vrlo povoljno za sinteriranje. Volfram-karbid ima tem peraturu taljenja 2800 C, ali uz dodatak kobalta on se gusto sinterira na tem peraturi 1400 C. Hlađenjem se stvaraju kristali volfram-karbida. K arbidi metala ne smiju se sinterirati u oksidaijskoj atmosferi. Zbog toga se m oraju upotrijebiti speijalne peći, koje se grade kao komorne i tunelske peći. Oksidna keramika. To su proizvodi velike gustoće i izvanredne tvrdoće, postojani na oksidativne i reduktivne uvjete do visokih tem peratura. Prim arna im je upotreba u aparatim a gdje je potrebna kemijska postojanost prem a djelovanju različitih agensa. Od takvih se masa proizvode svjećie za motore, različiti alati, pirom etarske ijevi, lani, kugle za mljevenje, kemijske pumpe, vodilie, mlaznie, ploče i si. D obivaju se iz taljene (sinterirane) glinie (A120 3) ili iz glinie i drugih oksida. S. 29. Dijagram taljenja sustava A120 3 S i0 2 s faznim sastavima Proizvodi se prešaju ili lijevaju pod tlakom na običnoj i povišenoj tem peraturi. K ompliirani kom adi oblikuju se izostatskim prešanjem. N a si. 29 dijagram je taljenja sustava Al20 3/S i0 2 iz kojeg se vidi kako siliij(v)-oksid (S i0 2) i aluminij()- C s N V 15> 2 5 ^ i S. 30. Dijagram spinela M go - MgO MgO ai2o 3 % MgO a i2o 3 -oksid (A120 3), već prem a sastavu i tem peraturi pečenja, tvore mineraloške sastave i mješavine faznih kom ponenata. Spinel M go A120 3 predstavnik je čitave jedne obitelji sastava koji slično kristaliziraju i imaju neka slična svojstva. Spineli se nalaze u općoj formuli M eno M e^o ^. N a toj se strukturi gradi niz sastava koji manifestiraju određena svojstva karakterizirana visokom čvrstoćom i stabilnošću na povišenim tem peraturama. N a si. 30 prikazan je dijagram taljenja sustava M go A Eutektikum se nalazi u sastavu 55% A120 3 i 2030 C, a druga točka u sastavu 97% A120 3 i 1925 C kao tem peratura taljenja. Visoka točka taljenja spinela pri 2135 C predstavlja sastav koji daje proizvod (materijal) još veće otpornosti na visokim tem peraturam a. L T. : E. yshkezvitsh, Oxydkeramik. Springer Verlag, Berlin Liebsehar-Willert, Tehnologie der Keramik. VEB Verlag D er K unst, D resden W. D. Kingeri, Cerami fabriation proesses. M assahusetts nstitute of Tehnology, F. Singer, S. S. Singer, ndustrial eramis. Cham pan & Hall Ltd, London E. Krause, Tehnologie der Grobkeramik. VEB Verlag für Bauwesen, Berlin F. Moore, heology of erami systems. nstitute of Ceramis, Textbook Series, London T. Haase, Keramik. VEB Deutsher Verlag für G rundstoffindustrie, Leipzig H. Salmang, H. Sholze, Die physikalishen und hemishen Grundlagen der Keramik. Springer Verlag, Berlin-Heildelberg-New York W. H inz, Silikate, sv. 1. i 2. VEB Verlag für Bauwesen, Berlin D. Biijak KETON, organski spojevi koji sadrže karbonilnu grupu ) - = o izravno vezanu na dva atom a ugljika. Kemijska im O je formula, dakle, C ' ili skraćeno CO', gdje su i ' bilo koje alkilne ili arilne grupe. Simetrični ketoni imaju jednake grupe i ', a miješani ketoni različite. U prirodi se u znatnijim količinama pojavljuju samo neke skupine ketona. M nogi makroiklički ketoni nalaze se u životinjskim izlučevinama. Steroidni ketoni uglavnom su horm oni kore nadbubrežne žlijezde i seksualni horm oni, dok se mnoštvo terpenskih ketona nalazi u prirodi u eteričnim uljima. K etoni se upotrebljavaju kao sirovine za laboratorijsko i industrijsko dobivanje mnogih važnih organskih spojeva, te kao otapala i sredstva za ekstrakiju. Upotrebljavaju se također u industriji lakova, plastičnih masa, bojila, mirisa, u farmaeutskoj i tekstilnoj industriji, te u mnogim drugim područjim a kemije i tehnologije. Nomenklatura ketona. Obična ( trivijalna) imena jednostavnih simetričnih ketona izvode se od imena kiseline koja bi pirolizom dala keton. Tako bi aeton, C H 3C O C H 3, m ogao nastati od dvije molekule otene kiseline (etanske kiseline, C H 3COOH), a i-butiron, (C H 3)2C H C O C H (C H 3)2, od dvije molekule /-maslačne kiseline (2-m etilpropanske kiseline, (CH 3)2CHCO O H ). Prem a drugom načinu, ketoni se imenuju tako da se imenima alkilnih ili arilnih grupa koje su vezane na karbonilnu grupu dodaje riječ keton. G rupe se navode redom prem a engleskoj abeedi: C H 3C O C H 3 aeton ili dimetilketon C H 3C O C 2H 5 etilmetilketon C 6H 5C O C H 3 aetofenon ili metilfenilketon Uobičajen je i stariji način imenovanja, prem a kojem se grupe u imenu ketona navode prem a složenosti npr. C H 3C O C 2H 5 naziva se metiletilketon. Za označavanje položaja supstituenata u ketonim a često se upotrebljavaju grčka slova. Alfabet počinje na ugljikovu atom u u susjedstvu karbonilne grupe. Ako obje grupe ( i ') sadrže supstituente, oba se lana označuju slovima, a rtia gore uz slovo upotrebljava se za razlikovanje dvaju lanaa: o BrCH2C H 2C O CH 3 ß-brometilmetilketon h 3 h i o h 2 h 2f a-klor-jß'-fluordietil keton
2 76 KETON Prem a sistematskoj nomenklaturi ketona (prema pravilima nternaionalne unije za čistu i primijenjenu kemiju, UPAC) ugljikov atom karbonilne grupe član je najdužeg lana ugljikovih atom a. K arbonilna grupa označuje se sufiksom (završetkom) -on, koji se dodaje imenu osnovnog ugljikovodika. Položaj karbonilne grupe označuje se brojem ako ime bez broja nije jednoznačno. Broj se stavlja ispred korijena imena ili ispred sufiksa -on. Smjer brojenja članova najdužeg lana odabire se tako da ugljik karbonilne grupe dobije što manji broj: C H 3 C O C H 2 C H 3 C H 3 C O C H 2 C H 2 C H 3 C H 3 C H 2 C O C H 2 C H 3 butanon C H 3 C O C H C H 2 C H 2 C H 3 C H 2 C H 2 C H 3 3-propil-2-heksanon 2-p en tanon (ili pentan-2-on ) 3-pentanon (ili pentan-3-on) C H 2 = C C O C H 2 C O C H 3 C H 2 C H 3 5 etil -5-heksen-2,4-dion Fizička svojstva ketona. K etoni male molekularne mase (C 3 i C 4) jesu tekućine karakterističnog mirisa, dobro topljivi u vodi, lako hlapljivi i destiliraju se bez raspadanja. Ketoni velike m olekularne mase jesu kristalinične tvari visokog vrelišta i dobro su topljivi u uobičajenim organskim otapalim a. Vrelište članova hom olognog niza ketona povećava se za ~ 2 0 C za svaku grupu C H 2. K etoni su polarni spojevi zbog dipolnog m om enta karbonilne grupe, pa imaju više vrelište od nepolam ih spojeva slične m olekularne mase kao što su alkani i eteri. O ni se ne m ogu međusobno vezati međum olekularnim vodikovim vezama jer ne sadrže vodikove atom e vezane na kisik, već samo na ugljik. Zbog toga ketoni imaju niže vrelište od alkohola i karboksilnih kiselina slične m olekularne mase. Ugljik karbonilne grupe ima trigonalnu hibridizaiju (sp2). Povezan je s kisikovim atom om i s dva a-ugljikova atom a (u grupam a i ') <r-vezama, koje leže u jednoj ravnini, a kutovi m eđu vezama iznose približno 2,09 radijana (120 ). 7r-veza karbonilne grupe okom ita je na ravninu u kojoj se nalaze r-veze: D, = o Duljina dvostruke veze C = 0 u ketonima iznosi 122 pm. Ta veza ima energiju oko 7,3 O5 Jm o l- 1 (175 k alm o l"x), što je više od dvostruke energije jednostruke veze C O u eterima, oko 3,5 105 Jm o l 1 (85 kalm ol-1 ). Kisik je znatno elektronegativniji od ugljika, pa je veza C = 0 polarizirana i ima dipolni m om ent usmjeren prem a kisikovu atom u. D ipolni m om ent zasićenih ketona iznosi 8,3---9,3 *O-3 0 C m (2,5-2,8 D), dok je za a, /^-nezasićene i a-arom atske ketone znatno veći. Spektroskopska svojstva ketona. K arbonilna grupa ketona pokazuje karakterističnu apsorpiju infrarvenog zračenja ( spektar), pa je ova vrsta spektroskopije izvrsna m etoda identifikaije i određivanja strukture ketona. Zasićeni aiklički ketoni pokazuju u spektru apsorpijsku vrpu oko 1715 m 1. Elektronegativne skupine vezane na a-ugljik pomiču apsorpijski m aksim um prem a višim frekvenijama. Tako npr. aeton apsorbira zračenje na 1715 m -1, monokloraeton, C H 3C O C H 2Cl, na 1735 m -1, a heksafluoraeton, C F 3C O C F 3, na 1800m 1. Sterički efekti koji uzrokuju prom jenu kuta C CO C također utječu na položaj apsorpijske vrpe. Cikloheksanon apsorbira na 1715 m -1, iklopentanon na 1745 m -1, iklobutanon na 1784 m -1, a heksametilaeton, (C H 3)3C CO C (C H 3)3, na 1686m -1. Za a,^-nezasićene i a-arom atske ketone položaj apsorpijske vrpe karbonilne grupe smanjuje se za 25-40m - 1 s obzirom na odgovarajuće zasićene ketone. Navedeni nezasićeni ketoni sadrže konjugirane nezasićene veze, pa apsorbiraju svjetlost u ultraljubičastom području (UV spektar) iznad 200 nm, za razliku od zasićenih ketona, koji u tom području ne pokazuju bitniju apsorpiju. Položaj apsorpijskog maksim um a u UV spektru a, ^-nezasićenih ketona daje informaije o broju i položaju supstituenata u konjugiranom sustavu. Osim toga, karbonilna grupa razotkriva protone vezane na a-ugljikove atome, pa oni u spektru protonske magnetske rezonanije pokazuju signal s karakterističnim kemijskim pom akom ó = 2,0-2,4 ppm (uz tetram etilsilan kao standard). Kemijska svojstva ketona. K arbonilna grupa na dvojaki način određuje kemijska svojstva ketona. Ta je grupa pogodno mjesto za adiiju nukleofila i za redukiju. O na također smanjuje kiselost vodikovih atom a koji su vezani na atom e ugljika u susjedstvu karbonilne grupe, što omogućuje reakije a-supstituije. K etoni se mogu oksidirati samo pod posebnim reakijskim uvjetima. U Baeyer-Villigerovoj oksidaiji ketoni se s peroksikiselinama prevode u estere: CO ' + " C 0 3H C O O ' + ' C O O H. (1) K etoni se mogu reduirati u sekundarne alkohole katalitičkim hidrogeniranjem u prisutnosti metalnih katalizatora. O bično se upotrebljavaju nikal, platina ili paladij, dok se u nekim reakijama upotrebljavaju rodij ili rutenij: _ katalizator C O ' + H * C H O H '. (2) U potreba te m etode ima niz ograničenja, jer se i mnoge druge skupine mogu katalitički hidrogenirati: alkenska veza Q = C, alkinska veza C eeec, nitro-grupa N 0 2, nitrilna grupa CN itd. eakijom ketona s kompleksnim metalnim hidridim a također nastaju sekundarni alkoholi: C O ' + 2 [H ] - C H O H '. ( 3) U tim su reakijama najvažniji litij-aluminij-hidrid, LiAlH 4 i natrij-bor-hidrid, N ab H 4. edukijom ketona s L1AH4 nastaje kompleks ( 'CH O )4AlLi, koji se dodatkom vode hidrolizira i daje sekundarni alkohol i smjesu litijevih i aluminijevih soli. Taj reagens reduira također mnoge druge funkionalne grupe koje sadrže kisik i dušik, što ograničava njegovu primjenu. N atrij-bor-hidrid je od njega m anje reaktivan i zbog toga je selektivniji u redukiji dvostruke veze. Taj je reagens znatno stabilniji u vodenim i alkoholnim otopinam a, osobito u lužnatoj sredini, ali je mnogo skuplji od litij-aluminij-hidrida. K etoni se mogu reduirati u sekundarne alkohole i Meerwein- -Ponndorf-Verleyevom reakijom, u kojoj nastaje ravnoteža između ketona i prim arnog ili sekundarnog alkohola u prisutnosti alum inij-alkoksida kao katalizatora. U toj se reakiji obično upotrebljavaju izopropanol i aluminij-izopropoksid. N a stali aeton uklanja se destilaijom, pa se redukija ketona može voditi do potpunosti, tj. sav se keton može reduirati: Al[OCH()2] 3 C O ' + (CH 3)2C H O H < = t C H O H ' + C H 3 C O C H 3. (4) K arbonilna grupa može se reduirati do metilenske grupe, C H 2, reakijom s amalgamiranim inkom i konentriranom solnom kiselinom u Clemmensenovoj redukiji, ili djelovanjem hidrazina, H 2N N H 2, i jake baze (npr. kalij-hidroksida ili alkalnog alkoksida) u Wolff-Kishnerovoj redukiji: - C O - ' Zn/Hg k n HC1> - C H 2- ' (5) CO ' + H 2N N H 2 - 'Q = N N H 2 + H 20 (6) N N H 2 baza zagrijavanje C H 2 ' + N 2 ( 7) Clemmensenova redukija primjenjuje se za spojeve osjetljive prem a bazama, a W olff-kishnerova redukija za spojeve osjetljive prema kiselinama. K etoni također podliježu bimolekularnoj redukiji i daju pinakole, simetrične glikole, 'C(O H ) C(OH)'. Ta se redukija obično provodi s magnezijem uz magnezij()-jodid, M gl2, ili s am algamiranim magnezijem: 22C = 0+ Mg Hg^ r2 r r2 r 2COOH M g 2+ - (COO)2Mg H O O H i ^ r 2 r2 (8)
3 KETON 77 Ketoni se mogu reduktivno aminirati reakijom s am onijakom i vodikom u prisutnosti m etalnog katalizatora. U prvom stupnju te reakije nastaje imin, koji se zatim katalitičkim hidrogeniranjem reduira u prim am i amin: ^ ^ O " C r / ^ O H + 'OH r; o r" H+ / i= ± r + H20 (15) r/ XO" ketal ' - h 2o C = 0 + NH3» / + H2o C = 0 + H 2N G- r/ eagens, H 2N G hidroksilamin, H 2N OH hidrazin, H 2N N H 2 fenilhidrazin, H 2N N H C6H 5 2,4-dinitrofenilhidrazin, 's C = N H, / v^ / N H G C ' V )H H2 / N i CH n h 2 mini, koji nastaju reakijom ketona s am onijakom, lako se hidroliziraju i daju ponovno slobodne ketone. Analognom reakijom ketona s prim am im aminima, "N H 2, nastaju supstituirani amini: ', / Produkt, 'C = N G oksim, 'C = N OH hidrazon, 'C = N N H? fenilhidrazon, 'C = N N H C 6H 5 2,4-dinitrofenilhidrazon, H,NNH n o 2 'C ~ N NH n o 2 o 2n 'C = 0 + "N H 2 'C = N " + H 20, (10) koji su veoma važni u biokemijskim proesima. ostali derivati amonijaka, H 2N G, adiraju se na karbonilnu grupu ketona: semikarbazid, H 2N N H C O N H 2 OjN semikarbazon, 'C = N N H C O N H 2 N astali produkti kristalinični su spojevi, slabo topljivi u vodi. M ogu se lako čistiti i imaju definirano talište, pa su vrlo korisni derivati za identifikaiju ketona. Ti su produkti bazični i reagiraju sa solnom kiselinom dajući hidrokloride koji su stabilniji od slobodnih produkata. Adiijom ijanovodika na karbonilnu grupu ketona nastaju ijanhidrini (a-hidroksinitrili): 'n C O + HCN» / H 3C = 0 + NaHS03, / '^ / C N C / ^ O H Adiijom jednog, odnosno dvaju m olova alkohola na karbonilnu grupu ketona nastaju poluketali, odnosno ketali: ( 9 ) C = N G +H 20 (11) (12) Ta se reakija obično provodi dodavanjem mineralne kiseline u smjesu ketona i vodene otopine natrij-ijanida, N acn. H i drolizom ijanhidrina nastaju a-hidroksikarboksilne kiseline, pa je ta reakija veoma korisna u sintezi niza važnih karboksilnih kiselina (mliječne kiseline, bademove kiseline i drugih, v. Karboksilne kiseline, TE 6, str. 661). Natrij-bisulfit, N a H S 0 3, veže se na karbonilnu grupu metilketona i daje kristalinične adiijske spojeve koji se mogu filtriranjem izdvojiti iz reakijske smjese. Ta se reakija primjenjuje za odvajanje aldehida i m etilketona od dialkilketona s većim grupam a od metilne i od spojeva koji ne sadrže karbonilnu grupu: H3( / S 0 3N a - A C3) x OH Te se reakije obično provode u prisutnosti bezvodnih kiselina, koje olakšavaju eliminaiju vode. avnoteža tih reakija obično je pom aknuta toliko ulijevo da ne nastaju znatne količine ketala. Zbog toga se ketali obično sintetiziraju reakijama ketona s alkilortoformijatima, C H (O )3, ili alkilsulfitima, (O)2SO. K etali su općenito stabilni u baznim uvjetima, dok se u kiseloj otopini hidroliziraju i ponovo nastaje keton. U organskih sintezama koje se provode u bazičnim uvjetima karbonilna grupa ketona često se zaštićuje prevođenjem u ketal. eakijom ketona s Grignardovim spojevima, "NJgX, nastaju terijarni alkoholi. G rignardovi spojevi pripravljaju se reakijom m etalnog magnezija s organskim halidom, "X. Adiijom G rignardova spoja na karbonilnu grupu ketona nastaje Grignardov kompleks, koji se zatim razori vodom. P ri tome nastaje terijarni alkohol i želatinozni talog HOM gx, koji se reakijom s razrijeđenom m ineralnom kiselinom prevodi u magnezijevu sol, topljivu u vodi: > = 0 + " M g X W X=Cl,Br ili N / * C 9 / V _ ) M g X +H2P., ' / ' ' r/ ^OH + H O M g X (16) Ketoni reagiraju s a-haloesterim a i metalnim inkom u neutralnim otapalim a (eter, toluen i si.) dajući /S-hidroksiestere (reakija eformatskoga): C = 0 +B rc H 2COOC2H5 + Z n +H 2P etil-bromaetat 'y y C H 2C O O C 2H5 / C 7 NOH '^ /C H 2C O O C 2H5 r / o Z n B r + HOZnBr (17) Ta je reakija srodna G rignardovoj' reakiji, ali ima nekih prednosti, jer su organoinkovi spojevi manje reaktivni od organomagnezijevih spojeva. Budući da se /?-hidroksikiseline lako dehidratiziraju, to reakijom eformatskoga može nastati i a, ^-nezasićeni ester. K etoni reagiraju s ilidima na tem peraturi 80 C i daju, prvo, dipolarni m eđuprodukt betain, a zatim neutralni spoj oksafosfetan. Taj se produkt zagrijavanjem do 0 C raspada i daje alken i trifenilfosfinoksid:, / t = : 0 + ( C 6H5)3 P = C " m ilid O P(C6H5)3 r: r " L oksafosfetan o - +p ( 6h 5)3 C C " ' betain (18) 0 C 'C =C "," + (C6H5)3 P = 0 C = 0 4- OH h + ' / O " 2 1 / C OH poluketal (14) Ta se m etoda sinteze alkena iz karbonilnih spojeva zamjenom karbonilnog kisika grupom = C " " ' naziva Wittigovom reakijom.
4 78 KETON eakijom ketona s fosfor( V)-kloridom na tem peraturi 0 C nastaju gem-dikloridi, 'CC12, kloralkeni, C C 1= C H 2, ili smjesa tih produkata: C O ' + PC15 -> CC12 ' + PO C 3 (19) C O C H 3 + PC15 C C 1 = C H 2 + P O C l3 + HC1. (20) Te su reakije uspješnije kad se provode s arom atskim nego s alifatskim ketonima. K etoni postoje u otopini u ravnotežnoj smjesi dvaju izomem ih oblika, /ero-oblika i enolnog oblika (enol je nezasićeni alkohol). Takvi izomeri koji mogu spontano jedan u drugi prelaziti nazivaju se tautom erim a, a pojava je poznata kao tautom erija: C C H 2 o keto-oblik C = C H ' OH enolni oblik (21) Proes enolizaije (prijelaz keto-oblika u enolni oblik) ketona kataliziraju i kiseline i baze. O ptički aktivni ketoni s asimetričnim ugljikom u a-položaju mogu se prevesti u inaktivnu smjesu (raemizirati) enolizaijom, jer se oba optički aktivna enantiom era keto-oblika mogu dovesti u ravnotežu s enolnim oblikom, koji je optički inaktivan: > H - - / ) " ' " ' " / / C = C ^ H C C / / OH O (22) Brzina raemizaije proporionalna je konentraiji ketona i konentraiji kiseline, odnosno baze. N apadom baze na vodik u a-položaju ketona nastaje enolat- -ion. Taj ion postoji u dva rezonanijska oblika koji sadrže negativni naboj na a-ugljiku, odnosno na kisiku: C C H 2 ' + OH O (23) C = C H 'l O- J +H2o Dvije molekule aldehida ili ketona koje imaju barem jedan vodik u a-položaju mogu u lužnatim uvjetima m eđusobno reagirati, pri čemu se a-ugljikov atom jedne molekule veže na karbonilni ugljik druge molekule. U toj reakiji zbiva s& zapravo, nukleofilna adiija enolat-iona jedne molekule na karbon ilnu grupu druge molekule i nastaju /?-hidroksialdehidi, odnosno /?-hiđroksiketoni. Ti se produkti nazivaju i aldolima, a reakija aldolnom kondenzaijom: ' " C ' 4- " C H 2 C " C C H C " O O OH O (24) Nastali produkti mogu se lako dehidratizirati zagrijavanjem s tragovima kiseline ili joda, pri čemu nastaju a,/^-nezasićeni karbonilni spojevi: ' " C C H C ' OH o ' r/ = o -" + H 20 (25) Ketoni se mogu halogenirati u a-položaju i dati a-haloketone: C O CH'" + X 2 - CO CX'" + HX, (26) X = Cl, Br ili. Te su reakije katalizirane kiselinama ili bazama. eakije katalizirane bazam a teku preko enolat-iona, koji reakijom s halogenom daje a-haloketon. Kiseline kataliziraju halogeniranje ketona protoniranjem kisikova atom a karbonilne grupe i stvaranjem enolnog oblika, koji također može reagirati s halogenom. H ipohalogenit-ion, - OX, u lužnatoj otopini također djeluje kao sredstvo za halogeniranje ketona. Ako a-ugljikov atom ketona nosi dva ili tri vodika, tada se drugi, odnosno treći vodikov atom može zamijeniti halogenom lakše od prvog. Zato se supstituija nastavlja na istom a-ugljikovu atom u sve dok se svi vodikovi atom i ne zamijene halogenom. M etilketoni pod tim uvjetima daju trihalogenirani produkt CO CX 3, koji nije stabilan u alkalnoj otopini i razgrađuje se dajući trihalogenmetan, CHX 3, i sol karboksilne kiseline: C O C H 3 + 3X O H CO CX 3 + 3X + 3 H 20 (27) CO CX3 + O H -* CO O + CHX 3. (28) Trihalogenm etani se općenito nazivaju haloformima, pa ta oksidaija ketona ima naziv haloformna reakija. Ta se reakija upotrebljava i za identifikaiju metilketona. dentifikaija se obično provodi jodoform nom reakijom, pri čemu se u toku reakije iz joda i natrij-hidroksida pripravlja natrij-hipojodit, koji s metilketonima daje žuti talog jodoform a, C H 3. H aloformna reakija primjenjuje se također u sintezi karboksilnih kiselina, pri čemu se upotrebljavaju natrij-hipobrom it, NaOBr, ili jeftiniji natrij-hipoklorit, NaOCl. D O B V A N JE KETONA Laboratorijski postupi. K etoni se mogu dobiti iz sekundarnih alkohola dehidrogenaijom ili oksidaijom. Dehidrogenaija se provodi zagrijavanjem para alkohola uz legure bakra kao katalizator: C H O H ' katalizator zagrijavanje C O ' + H 2, (29) dok se oksidaija sekundarnih alkohola provodi različitim sredstvima za oksidaiju. Za taj se postupak najčešće upotrebljava vodena otopina kalij-dikrom ata, otopina krom(v)-oksida u sum pornoj kiselini, bezvodnoj otenoj kiselini ili u piridinu, te vruća vodena otopina kalij-permanganata. Oksidaija sekundarnih alkohola može se također provesti kisikom iz zraka u prisutnosti metalnih katalizatora i uz zagrijavanje: C H O H ' + [O ] - C O ' + H 20. (30) Ketoni se mogu dobiti oksidativnim ijepanjem višestrukih veza između ugljikovih atom a. O sobito je važna ozonoliza alkena. Adiijom ozona na alkensku vezu nastaje ozonid, koji hidrolizom daje aldehide ili ketone, ili obje vrste spojeva. azgradnja ozonida obično se provodi pod redukijskim uvjetima, uz inkov prah i otenu kiselinu: ' " / / -. +H 2O, - H j O f + O j ', = o + o = / n / / C C / w. Hidrataija alkina prikladna je m etoda za dobivanje aldehida, a rjeđe se primjenjuje u pripravi ketona. Ta se reakija provodi sa sum pornom kiselinom uz živine soli kao katalizator: / (31) G s C ' + H 20 > CH 2CO'. (32) K etoni se također dobivaju reakijom derivata karboksilnih kiselina s organom etalnim spojevima. Najčešće se provodi reakija kiselinskih klorida s organokadmijevim spojevima, 2Cd,
5 KETON 79 koji se dobivaju iz G rignardovih spojeva, MgX, i bezvodnog kadm ij()-klorida: 2M gx + CdCl2 -> 2Cd + 2M gxcl (33) 2Cd + 2 COC1 -> 2 C O ' + C dcl2. (34) U tim su reakijama dovoljno stabilni i mogu se upotrijebiti samo oni organokadm ijevi spojevi koji sadrže arilne ili prim arne alkilne grupe. U sprkos tom ograničenju ta je m etoda jedna od najboljih laboratorijskih m etoda za dobivanje ketona. O rganokadmijevi spojevi manje su reaktivni od G rignardovih spojeva i ne reagiraju s ketonima, pa se prikazana reakija s kiselinskim kloridom ne može nastaviti do stupnja terijarnog alkohola. Za razliku od Grignardovih spojeva, organokadm i jevi spojevi ne reagiraju s mnogim funkionalnim grupam a, npr. N 0 2, CN, C O O i si., što također povećava primjenljivost te metode. Alkiliranjem etil-aetoaetata, C H 3C O C H 2C O O C 2H 5, dobivaju se alkilni derivati aetona, u kojima su jedan ili dva vodikova atom a zamijenjeni alkilnim grupam a. Aetoaetat se s natrij-etoksidom prevodi u natrijevu sol aetoaetata, koja alkiliranjem s alkilhalidom, X, u bezvodnom alkoholu daje (mono)alkilaetoaetat. Zagrijavanjem m onoalkilaetoaetata u razrijeđenoj vodenoj otopini lužine zbiva se hidroliza estera. N akon zakiseljavanja iz hidrolizata se dobiva /?-ketokiselina, C H 3C O C H C O O H, koja se spontano dekarboksilira i daje keton tip avc H 3C O C H 2: } C H 3C O C H 2 - C O O C 2H 5 2i l 5-Q - N a >C H 3C O C H C O O C 2H 5Na f - - ~X -* C H 3C O C H C O O C 2H 5 C H 3C O C H o o -> - N a X a-(monq)alkilaetoaetat (35) C H 3C O C H C O O H COCH2. monosupstituirani aeton M onoalkilaetoaetat se može i ponovno alkilirati i opisanim postupkom dobiti a,a-disupstituirani aeton, C H 3C OCH '. Termičkom dekarboksilaijom barijevih ili kalijevih soli m onokarboksilnih kiselina (ali ne mravlje kiseline) dobivaju se simetrični ketoni, dok se zagrijavanjem smjese kalijevih soli različitih kiselina dobivaju uz simetrične i miješani ketoni. Soli dikarboksilnih kiselina daju tim postupkom ikličke keton e: 2 C O O H + C a(o H )2 ~ 2H2 > (COO)2Ca - -» C O + C a C 0 3 (36) (COO)2Ca + ( C O O )2Ca -> 2 C O ' + 2 C a C 0 3. (37) skorištenje tih reakija je slabo, pa one nisu mnogo važne. N ajbolja m etoda dobivanja arom atskih ketona je Friedel- -Craftsovo ailiranje arom atske jezgre s kiselinskim kloridima ili anhidridim a. U toj je reakiji potrebna neka Lewisova kiselina, npr. A1C13: C O Cl + A rh - C O Ar + HC1 (38) ( C 0 )20 + ArH C O Ar + CO O H. (39) K etoni se također mogu dobiti Oppenauerovom oksidaijom sekundarnih alkohola, pinakolnom pregradnjom 1,2-diola, oksidaijom alkena natrij-perjodatom uz osmij(v)-oksid, zatim hidroboriranjem alkena i karboniliranjem nastalog alkilborana, te drugim manje važnim postupima. ndustrijske metode dobivanja ketona. Oksidaija ugljikovodika obično je jeftina i pristupačna m etoda dobivanja ketona. U nekim slučajevima keton se dobiva direktno iz ugljikovodika uz visoko iskorištenje. U drugim postupim a prvo se dobiva sekundarni alkohol ili smjesa alkohola i ketona kao međuprodukt, a zatim se alkohol prevodi u keton. eakije se obično provode na tem peraturi C pod tlakom od 0,2 0,7 M Pa. Najčešće se ugljikovodik stavlja u reaktor, otopina m angan-aetata (koji se upotrebljava kao katalizator) uvodi se na vrhu reaktora, a zrak se propuhuje kroz otopinu s dna reaktora. Zatim se tekućina s dna reaktora prebauje u drugi reaktor, gdje se ponovno propuhuje zrak, pri čemu ukupno kontaktno vrijeme iznosi 15 sati. Produkt se obrađuje vodenom otopinom natrij-hidroksida, pri čemu se ekstrahiraju kiseline i istaloži katalizator. Destilaijom organskog sloja dobiva se keton, a kao sporedni produkt nastaje sekundarni alkohol, koji se zatim može katalitički dehidrogenirati. K etoni se, osim toga, dobivaju dehidrogenaijom (reakija 29) ili oksidaijom (reakija 30) sekundarnih alkohola kao polaznog materijala. U oba se postupka pare alkohola prevode preko katalizatora. Produkt se hladi i ispire vodom, a zatim se dobivena smjesa ketona, sekundarnog alkohola i vode razdvoji destilaijom. U reakiji se upotrebljavaju različiti katalizatori u širokom tem peraturnom području. Pri dehidrogeniranju kao katalizatori primjenjuju se ink-oksid, bakar()-oksid s primjesama krom(v)-oksida, bakar, rezličite legure bakra i različite bakrene soli, a reakija se obično zbiva na tem peraturi C. Oksidaija se provodi kisikom iz zraka na temperaturi oko 500 C uz bakar, ink ili srebro kao katalizator. Pri oksidaiji kritična je tem peraturna kontrola, te omjer kisika i alkohola. Mnogi ketoni dobivaju se u industrijskoj praksi i aldolnom kondenzaijom. Obično se provodi kondenzaija ketona s formaldehidom, aetaldehidom, aetonom,, ili se keton dimerizira samokondenzaijom. O stale važnije m etode proizvodnje ketona navedene su u prikazu pojedinih ketona. TEHNČK VAŽNJ KETON Aeton (dimetilketon, propanon), C H 3C O C H 3, prvi je član homolognog niza alifatskih ketona i tehnički najvažniji keton. Njegova fizička svojstva, a i svojstva ostalih ketona važnih u tehničkoj praksi, navedena su u tabl. 1. U gotovo svim metodam a proizvodnje aetona danas se kao sirovina upotrebljava petrokemij^ki dobiveni propen, ili izopropanol koji se proizvodi kiselokataliziranom hidra taijom propen a. Najvažniji postupak industrijskog dobivanja aetona jest katalitičko dehidrogeniranje izopropanola u plinovitoj fazi (si. 1): C H 3C H O H C H 3 -* C H 3C O C H 3 + H 2. (40) Taj je proes izrazito endoterman. Aeton se dobiva s maksimalnim iskorištenjem na tem peraturi oko 350 C, a reakija se provodi pod tlakom oko 8 M Pa. Uobičajeni katalizatori u tom proesu jesu bakar, ink, olovo, brona i metalni oksidi. Aeton se također proizvodi direktnom oksidaijom propena kisikom iz zraka (si. 2). Tim se proesom dobiva aeton s S. 1. Proizvodnja aetona dehidrogeniranjem izopropanola u plinovitoj fazi. 1 reaktor, 2 destilaijske kolone, 3 hladilo za duboko hlađenje Propionaldehid S. 2. Proizvodnja aetona direktnom oksidaijom propena. 1 reaktor za oksidaiju katalizatora, 2 odjeljivač suvišnog zraka, 3 reaktor za oksidaiju propena, 4 rpka za reirkulaiju katalizatora, 5 kolona za odvajanje katalizatora, 6 kolona za destilaiju frakija s niskim vrelištem, 7 kolona za destilaiju aetona
6 80 KETON Naziv T a b li a 1 FZČKA SVOJSTVA N EK H TEH N Č K VAŽNH KETONA Formula Talište Vrelište C Gustoća d l0 ndeks loma 2 0 nd Aeton C H 3 C O C H 3-9 4,8 56,2 0,7908 1,359 M etiletilketon C H 3C O C 2 H 5-8 6,9 79,6 0,8047 1,3788 Metilizopropilketon C H 3 C O C H ( C H 3 ) ,5 0,8033 1,3890 Metilizobutil keton C H 3 C O C H 2 C H ( C H 3 ) 2-84,7 115,9 0,8004 1,3959 Metil-s-butilketon C H 3C O C H ( C H 3 ) C H 2C H ,8130 1,4012 Pinakolon C H 3 C O C ( C H 3 ) 3-4 9, ,80121} 1,3956 Metilizoamilketon C H 3 C O C H 2 C H 2 C H ( C H 3) ,8133 1,4078 Dietilketon C 2 H 5 C O C 2 H 5-3 9,8 101,7 0,8138 1,3927 Etilamilketon C 2 H 5C O C H 2 C H ( C H 3 ) C H 2 C H 3 159,2 0,820 1,4209 Diizobutilketon ( C H 3 )2 C H C H 2 C O C H 2 C H ( C H 3 )2-4 1,5 168,1 0,8060 1,4114 Metil vinilketon C H 3 C O C H = C H 2 81,4 0,8636 1,4081 Metilizopropenilketon C H 3 C O C ( C H 3 ) = C H ,855 1,4236 Mezitiloksid ( C H 3) 2 C = C H C O C H ,5 0,8548 1,4458 Hidroksiaeton C H 3C O C H 2 O H ,08242) 1,4295 Diaetonalkohol ( C H 3 )2C ( O H ) C H 2 C O C H ,9 0,9382 1,4241 Diaetil C H 3 C O C O C H 3-2,5 88 0,9831 1,3951 Aetilaeton C H 3 C O C H 2C O C H 3-2 3, ,9728 1,4522 Cikloheksanon 0 = 0 zoforon 3< Y H 3C VCHj ,5 0,9455 1,4552 « ,922 1,4759 Aetofenon C 6H5CO CH 3 19,5 202,4 1,0280 1,5372 Benzofenon (a) i 48,1 305,4 1,146 1,6077 C 6H 5C O C 6H 5 Benzofenon (/?)/ 26 1,1076 1,6059 A) d l5, 2> d l iskorištenjem ~ 9 2 %, a kao sporedni produkt (~ 3 % ) nastaje propionaldehid : h = h 2 + o 2 CO } CH 3CH2CHO eakija se obično provodi na tem peraturi C i pod tlakom 1,0 -l,4m P a, uz bakar()-klorid i paladij()-klorid kao katalizatore. Aeton se dobiva i kao koprodukt u proizvodnji fenola kiselokataliziranom oksidaijom kum ena iz zraka: C6H5 CH H C H, C6H5 O OH C 6H5 OH + C H 3C O C H 3 (42) Također se proizvodi oksidaijom izopropanola u plinovitoj fazi, te oksidaijom nižih alkana. Aeton se upotrebljava kao sirovina za proizvodnju diaetonalkohola, mezitiloksida, metilizobutilketona, aetonijanhidrina, izoforona i u mnogim drugim tehnički važnim sintezama. U potrebljava se u industriji plastičnih masa i služi kao otapalo za mnoge prirodne i sintetske smole (npr. za nitroelulozu, aetilelulozu, eluloid, klorkaučuk, polivinilaetat, poliakrilaetat), a također i kao m nogostrano i jeftino otapalo i sredstvo za ekstrakiju u različitim područjim a organske kemije i tehnologije. H3C ^ / OH Aetonijanhidrin, C, dobiva se u industrijskoj H3 / XCN praksi uglavnom baznokataliziranom adiijom ijanovodične kiseline na aeton. Ta se reakija obično provodi u tekućoj fazi na tem peraturi oko 40 C, uz alkalni hidroksid ili karbonat. G otovo sav proizvedeni aetonijanhidrin prerađuje se u ester i druge derivate m etakrilne kiseline. Neki derivati aetonijanhidrina imaju fungiidno, herbiidno i insektiidno djelovanje. Diaetonalkohol, (C H 3)2C(O H)CH 2C O C H 3 (4-hidroksi-4- -metil-2-pentanon), proizvodi se baznokataliziranom dimerizaijom aetona. Taj se proes obično provodi na tem peraturi C, uz alkalne i zemnoalkalne hidrokside kao katalizatore. D iaetonalkohol se u prvom redu upotrebljava kao sirovina za proizvodnju mezitiloksida, metilizobutilketona i 2-metil-2,4-pentandiola, te kao otapalo u industriji lakova. Hidroksiaeton, C H 3C O C H 2OH, dobiva se katalitičkim dehidrogeniranjem 1,2-propandiola u plinovitoj fazi. U potrebljava se kao sirovina u sintezi heteroikličkih spojeva. Metiletilketon (butanon), C H 3C O C H 2C H 3, nakon aetona tehnički je najvažniji keton. Više od 80% svjetske proizvodnje tog ketona zasniva se na postupku dehidrogenaije ili oksidaije s-butanola (koji se može lako proizvesti iz petrokemijski pristupačnog r-butena): C H 3C H O H C H 2C H 3 - C H 3C O C H 2C H 3 + H 2. (43) Butanol se obično katalitički dehidrogenira u plinovitoj fazi. Taj je proes endoterm an, a metiletilketon dobiva se s m aksimalnim iskorištenjem na tem peraturi oko 350 C. Uobičajeni katalizatori u toj reakiji jesu bakar, ink ili brona. Jednostepeni postupak proizvodnje metiletilketona iz n-butena hidrataijom uz oksidaiju nema veće tehničko značenje. M anja količina metiletilketona dobiva se kao sporedni produkt prilikom oksidaije «-butana u otenu kiselinu. Taj se postupak obično provodi u tekućoj fazi i bez katalizatora. M etiletilketon upotrebljava se kao otapalo za plastične mase, te prirodne i sintetske smole (npr. kolofonij, kolodij, nitroeluloza, akrilatne smole, polistiren, klorkaučuk, polivinilaetat i si.). U potrebljava se također i kao sredstvo za ekstrakiju masti, ulja i smola, za uklanjanje alkana iz mineralnih ulja, te u proizvodnji umjetne kože i sintetskih bojila. Metilizopropilketon, C H 3C O C H (C H 3)2 (3-metilbutanon). Najvažnija m etoda za dobivanje tog ketona jest kiselokatalizirana kondenzaija metiletilketona i formaldehida u tekućoj fazi. Tim se postupkom dobiva metilizopropenilketon, koji se zatim selektivno hidrogenira: COCH2 +H C H O - ^ C H 3C O C = C H 2 + h 2o (44)
7 KETON 81 COC = CH2 + H2 COCH()2 (45) M etilizopropilketon može se također dobiti kondenzaijom izobutiraldehida i aetaldehida u tekućoj fazi: ()2C H C H O + CHO - (CH 3)2C H C O C H 3 + C O + H 2. (46) U potrebljava se u farmaeutskoj industriji, u proizvodnji herbiida, indigoidnih bojila za tkanine i kemikalija u fotografskoj industriji, te za selektivnu ekstrakiju lantanidnih spojeva. Metilizobutilketon, C H 3C O C H 2C H (C H 3)2 (4-metil-2-pentanon), proizvodi se industrijski iz aetona ili izopropanola različitim postupima. Najveća količina tog ketona dobiva se danas iz aetona trostepenim postupkom, preko diaetonalkohola i mezitiloksida kao m eđuprodukata. U prvom stupnju tog postupka blagim lužnatim dimeriziranjem aetona nastaje diaetonalkohol, koji se u drugom stupnju dehidratizira u mezitiloksid. Taj se drugi stupanj provodi u tekućoj fazi na tem peraturi C i uz kiseli katalizator. Selektivnim katalitičkim hidrogeniranjem mezitiloksida u tekućoj ili plinovitoj fazi dobiva se metilizobutilketon. Taj se keton proizvodi iz aetona i dvostepenim postupkom, pri čemu se aeton kondenzira u jednom stupnju u mezitiloksid u tekućoj ili plinovitoj fazi uz kiseli ili lužnati katalizator. M etilizobutilketon također se dobiva direktno iz aetona i vodika jednostepenim postupkom, u kojem se upotrebljava smjesa različitih katalizatora. Osim toga, taj keton nastaje kao sporedni produkt pri dehidrogeniranju izopropanola u proizvodnji aetona. U potrebljava se kao otapalo za nitroelulozne i akrilatne lakove, kao selektivno otapalo za uklanjanje alkana iz frakija mineralnog ulja u proizvodnji ulja za podmazivanje, te u proizvodnji ljepila i farmaeutskih preparata. Metil-s-butilketon, COCH()CH2 (3-metil-2- pentanon), dobiva se iz metiletilketona i aetaldehida baznokataliziranom aldolnom kondenzaijom, nakon koje slijedi kiselokatalizirana dehidrataija i selektivno hidrogeniranje uz paladij. U potrebljava se u proizvodnji herbiida i juvenilnih horm ona, te kao sirovina u sintezi složenih arom atskih alkohola. Pinakolon, C H 3C O C (C H 3)3 (metil-i-butilketon, 3,3-dimetil- -2-butanon), može se pripraviti reduktivnim dimeriziranjem aetona uz kiseli katalizator. U toj se reakiji otjepljuje voda i premješta se m etilna grupa. Takav premještaj poznat je pod nazivom pinakolna pregradnja 2 (C H 3)2 CO + H 2 ()2C C()2 OH OH -C H 3C C (C H 3)3 +H2o. o (47) Pinakolon se u industrijskoj praksi obično dobiva direktno iz aetona jednostepeno, redukijom amalgamiranim inkom i konentriranom solnom kiselinom. Također se proizvodi Prinsovom reakijom izoprena i formaldehida uz mineralne kiseline. U potrebljava se u nizu tehnički važnih sinteza (dobivanje supstituiranih estera karbam inske kiseline, pinakolonoksima i fozgena), te u proizvodnji insektiida, herbiida i farmaeutskih preparata. Metilizoamilketon, C H 3C O C H 2C H 2C H (C H 3)2 (5-metil-2- -heksanon), dobiva se iz aetona i izobutiraldehida baznokataliziranom aldolnom kondenzaijom, nakon koje slijedi dehidrataija i selektivno hidrogeniranje uz paladij. Ta se aldolna kondenzaija u industriji obično provodi u plinovitoj fazi na tem peraturi 350 C, uz kositar i silikagel. M etilizoam ilketon upotrebljava se kao sirovina u proizvodnji lakova. O topine akrilatnih smola, eluloznih estera i nitrata u tom ketonu imaju nisku viskoznost. Viši metil-n-alkilketoni (2-alkanoni), C H 3CO, proizvode se različitim postupima. Najvažnija m etoda industrijske proizvodnje tih ketona jest oksidaija viših a-alkena, koji se u novije vrijeme dobivaju termičkim ijepanjem čvrstih alkana ili iz etilena. O stali važniji postupi dobivanja viših 2-alkanona jesu katalitička oksidaija ili dehidrogeniranje 2-alkanola, kondenzaija otene kiseline i masnih kiselina, kondenzaija aetona ili aetaldehida s višim aldehidima, radikalska adiija aetaldehida na a-olefin, te direktna oksidaija «-alkana. Ti se ketoni upotrebljavaju u osobite svrhe kao nehlapljiva otapala, npr. za poboljšavanje svojstava nekih frakija m ineralnog ulja, te u proizvodnji smola i gume. Njihovi su derivati antioksidansi i upotrebljavaju se za ubrzavanje vulkanizaije. Dietilketon, C 2H 5C O C 2H 5 (3-pentanon), dobiva se katalitičkom kondenzaijom propanske kiseline ili hidroformiliranjem etilena. U potrebljava se kao otapalo za lakove i kao sirovina u nizu organskih sinteza (npr. u proizvodnji trimetilfenola). Etilamilketon, C H 3C H 2C O C H 2C H (C H 3)C H 2C H 3 (5-metil- -3-heptanon), dobiva se iz metiletilketona baznokataliziranom sam okondenzaijom, nakon koje slijedi hidrogeniranje. U potrebljava se u industriji lakova kao otapalo visokog vrelišta. Diizobutilketon, (CH 3)2C H C H 2C O C H 2C H (C H 3)2 (2,6-dimetil-4-heptanon), proizvodi se industrijski kondenzaijom izopropanola u plinovitoj fazi, uz katalitičko dehidrogeniranje. U potrebljava se kao otapalo u industriji lakova, zatim prilikom uklanjanja alkana iz mineralnih ulja i kao sredstvo za dispergiranje fluoriranih polimera. Metilvinilketon, C H 3C O C H = C H 2 (butenon), dobiva se adiijom vode na vinilaetilen, uz živine soli kao katalizator: C H = C C H = C H 2 + H 20 - C H 3C O C H = C H 2. (48) ndustrijski se također proizvodi M annihovom reakijom ili kondenzaijom aetona i formaldehida. Taj je keton važna sirovina u farmaeutskoj industriji (proizvodnja vitamina A, adam ona i akinetona), a neki njegovi derivati imaju fungiidno djelovanje (ronilan). Metilizopropenilketon, C H 3C O C (C H 3)==CH2 (3-metil-3-buten-2-on), dobiva se kiselokataliziranom kondenzaijom m etiletilketona i formaldehida. U potrebljava se u proizvodnji metilizopropilketona i kao sirovina u farmaeutskoj industriji. Mezitiloksid, (CH 3)2C = C H C O C H 3 (4-metil-3-penten-2-on), dobiva se kondenzaijom aetona i uglavnom se upotrebljava kao m eđuprodukt u proizvodnji metilizobutilketona. D obro je otapalo u industriji lakova (nitroeluloza, elulozni esteri, kaučuk), ali je upotreba tog ketona ograničena zbog njegove toksičnosti i nestabilnosti. Diaetil, C H 3C O C O C H 3 (2,3-butandion), dobiva se uglavnom oksidaijom metiletilketona. U potrebljava se u prehram benoj industriji kao sastavni dio aroma. stu primjenu imaju i viši članovi homolognog niza, 2,3-pentandion i 2,3-heksandion. Aetilaeton, C H 3C O C H 2C O C H 3 (2,4-pentandion), proizvodi se pregradnjom izopropenilaetata na tem peraturi ~ 520 C, pod norm alnim tlakom i uz katalizator: H 2C = C (C H 3) O C O C H 3 - C H 3C O C H 2C O C H 3. (49) Enolni oblik tog ketona, a i svih 1,3-diketona, znatno je stabilniji od enolnog oblika jednostavnih ketona: f / o CH2 / H,C CH CH, / / C CH CH, A / / v / 7 3 H o o V ' (50) Vodik je enolne hidroksilne skupine kiseo i može disoirati, pri čemu nastaje enolat-anion, koji s kationim a daje soli, aetilaetonate. S metalnim ionima koji u svoju valentnu ljusku m ogu smjestiti više od jednog para elektrona enolna hidroksilna skupina stvara sol, dok se karbonilna grupa koordinativno veže s metalnim kationom dajući kelatni prsten: TE V, 6
8 82 KETON - KBENETKA 1 V V = o o, HC / V / o o = h H3C bakar-aetilaetonat Takvi metalni kompleski nemaju svojstva soli, nego se ponašaju kao kovalentni spojevi. Topljivi su u organskim otapalim a i imaju tališta u vrlo uskom tem peraturnom području. M etalni aetilaetonati upotrebljavaju se kao sredstva za ekstrakiju m etala u kemijskoj industriji, metalurgiji i rudarstvu. U analitičkoj kemiji primjenjuju se za dokazivanje i određivanje metala. O stali derivati aetilaetona također imaju široku primjenu, osobito u tekstilnoj i farmaeutskoj industriji, zatim u industriji lijekova, bojila i plastičnih masa. Cikloheksanon ^ p industrijski se proizvodi različitim postupima. Najvažnija m etoda proizvodnje jest katalitička hidrogenaija fenola, koja se provodi u plinovitoj fazi na tem peraturi oko 160 C: Benzofenon, C 6H 5C O C 6H 5 (difenilketon), dobiva se kondenzaijom benzena i tetraklorm etana uz aluminij ()-klorid kao katalizator, te hidrolizom nastalog m eđuprodukta: 2 C 6H 6 + CC14 C 6H 5CC12C 6H HC1 (54) C 6H 5CC12C 6H 5 + H 20 C 6H 5C O C 6H 5 + 2HC1. (55) Benzofenon se upotrebljava kao sirovina u industriji parfema, u farmaeutskoj industriji, te u nizu organskih sinteza. 4,4'-bis(dimetilamino)-benzofenon (Mihlersov keton) H,C dobiva se kondenzaijom dimetilanilina i fozgena uz ink()- -klorid kao katalizator. U potrebljava se kao sirovina u industriji bojila i kao iniijator u proesu fotopolimerizaije. 9,10-antrakinon O OH + 2 H2 O (51) Cikloheksanon se, osim toga, proizvodi katalitičkim hidrogeniranjem ikloheksanola, te direktnom oksidaijom ikloheksana u tekućoj fazi. G otovo sav proizvedeni ikloheksanon upotrebljava se kao sirovina za dobivanje -kaprolaktama. Ako se -kaprolaktam zagrijava na 250 C u prisutnosti kiselih ili baznih katalizatora, prelazi u linearni polimerni amid -fn H (C H 2)5C O Jr, koji se može ispredati u vlakna poznata kao Nylon 6. Cikloheksanon se također upotrebljava za proizvodnju adipinske kiseline, zatim kao otapalo u industriji lakova, te u tekstilnoj industriji. zoforon (3,5,5-trimetil-2-ikloheksen-l-on), proizvodi se kiselokataliziranom kondenzaijom aetona u tekućoj fazi. U potrebljava se kao otapalo u industriji lakova i kao sirovina u proizvodnji pestiida. Makroiklički ketoni koji sadrže četrnaest do sedamnaest atom a u prstenu imaju karakterističan miris m ošusa i upotrebljavaju se u industriji parfema. Najvažniji ketoni iz ove grupe spojeva su m uskon i ibeton, izolirani iz životinjskog sekreta, te egzalton, koji se proizvodi industrijski kao zamjena za prirodni mošus: ç = o (CH2),4 C H 3 C H C H 2 C = 0 H C ( h 2 ) 7 ~ > / ich2)12- muskon HC (CH^J ibeton egzalton Aetofenon, C 6H 5C O C H 3 (metilfenilketon). N ajstariji postupak za sintezu tog spoja jest Friedel-Craftsova reakija benzena i aetanhidrida: 2C 6H 6 + (C H 3C 0 )20 2C 6H 5C O C H 3 + H 20. (52) D anas se aetofenon industrijski dobiva mnogo jeftinijim postupkom, katalitičkom oksidaijom etilbenzena kisikom iz zraka: C 6H 5C H 2C H C 6H 5C O C H 3 + H 20. (53) U potrebljava se u proizvodnji plastičnih masa, bojila i farm aeutskih proizvoda (kloramfenikol), te kao otapalo. dobivao se ranije oksidaijom antraena, dok se sada proizvodi Friedel-Craftsovom reakijom benzena i ftalanhidrida. Derivati antrakinona upotrebljavaju se u industriji bojila. Terpenski ketoni. M noštvo spojeva iz skupine terpenskih ketona nalazi se u prirodi u eteričnim uljima (v. Eterična ulja, TE 5, str. 360). Terpenski ketoni imaju ugodan miris, pa se upotrebljavaju u industriji parfema (jonon, pseudojonon, metiljonon, m enton, pulegon, piperiton, iron, jasm on, tujon, verbeton, vetivon), kozmetičkih preparata (fenkon), te u prehram benoj industriji (karvon). Jonon (izomeri a, ß i y) jest sirovina za proizvodnju vitamina A. Kam for je biiklički terpenski keton koji se upotrebljava u mediini i veterini (kao analeptik), te u proizvodnji eluloida. Steroidni ketoni. Neki od tih ketona (testosteron, androsteron, progesteron, estron) jesu seksualni horm oni, dok su drugi spojevi iz te skupine (aldosteron, kortikosteron, dehidrokortikosteron, kortizon, kortizol) kortikosteroidi koji reguliraju metabolizam ugljikohidrata. L T.: C. D. Gutshe, T he hemistry of arbonyl ompounds. Prentie-Hall, Englewood Cliffs, N. J J. D. oberts, M. C. Caserio, Basi priniples of organi hemistry. W. A. Benjamin, M enlo Park, California A. Streitwieser,Jr., C. H. Heathok, ntrodution to organi hemistry. M amillan Publishing Co., New York T. Morrison,. N. Boyd, Organi hemistry. Allyn and Baon, Boston C.. Noller, Kemija organskih spojeva. Tehnička knjiga, Zagreb J. K. Stille, ndustrial organi hemistry. Prentie-Hall, Englewood Cliffs, N. J J. Wöllner, E. Weber, Aeton, u djelu Ullmanns Enyklopädie der tehnishen Chemie, Bd. 7. Verlag Chemie, W einheim W. Fliege i sur., Ketone, aliphatishe,. Brokhaus i sur., Ketone, aromatishe, u djelu Ullmanns Enyklopädie der tehnishen Chemie, Bd. 14. Verlag Chemie, W einheim M. Ladika KBENETKA, znanost o općim zakonitostim a proesa upravljanja, reguliranja, dobivanja, pohranjivanja, pretvorbe i prijenosa informaija u sustavima, neovisno o njihovoj fizikalnoj prirodi. ako se pojam kibemetike upotrebljavao još u staroj Grčkoj (grč. xvpqveïv kibernein upravljati), njezine je temelje u današnjem smislu postavio god. američki znanstvenik N orbert Wiener u knjizi Cybernetis or ontrol and ommuniation in the animal and the mahine. Pronalazeći opće zakonitosti koje su primjenljive u različitim područjima znanosti, kibemetika je postala sintetička disiplina koja je omogućila dublji uvid u ostala područja znanosti, njihov dalji i intenzivniji razvoj, te prenošenje spoznaja iz jednog u druga znanstvena područja. Polazeći od informaijsko-sustavnog gledišta, kibernetika je bitno utje-
Microsoft PowerPoint - IR-Raman1 [Compatibility Mode]
![Microsoft PowerPoint - IR-Raman1 [Compatibility Mode] Microsoft PowerPoint - IR-Raman1 [Compatibility Mode]](/thumbs/101/149990971.jpg) Spektar elektromagnetnoga t zračenja 10 5 10 3 10 1 10-1 10-3 10-5 10-7 E(kJ/mol) 10-6 10-4 10-2 1 10 2 10 4 10-8,cm X UV zrake zrake prijelazi elektrona IR mikrovalovi radiovalovi vibracije rotacije prijelazi
Spektar elektromagnetnoga t zračenja 10 5 10 3 10 1 10-1 10-3 10-5 10-7 E(kJ/mol) 10-6 10-4 10-2 1 10 2 10 4 10-8,cm X UV zrake zrake prijelazi elektrona IR mikrovalovi radiovalovi vibracije rotacije prijelazi
Alkeni nastavak
 Alkeni nastavak 2. Dehidratacija alkohola U industriji: prevođenjem alkoholnih para preko Al 2 O 3 (Lewis-ova kiselina). Laboratorijsko dobijanje Akohol može biti: 3, 2 ili 1. THF tetrahidrofuran -rastvarač
Alkeni nastavak 2. Dehidratacija alkohola U industriji: prevođenjem alkoholnih para preko Al 2 O 3 (Lewis-ova kiselina). Laboratorijsko dobijanje Akohol može biti: 3, 2 ili 1. THF tetrahidrofuran -rastvarač
Microsoft PowerPoint - TPOI_07&08_Halogeniranje & Alkilacija_(produkti) [Compatibility Mode]
![Microsoft PowerPoint - TPOI_07&08_Halogeniranje & Alkilacija_(produkti) [Compatibility Mode] Microsoft PowerPoint - TPOI_07&08_Halogeniranje & Alkilacija_(produkti) [Compatibility Mode]](/thumbs/101/151947582.jpg) Fakultet kemijskog inženjerstva i tehnologije Diplomski studij: Kemijsko inženjerstvo Kolegij: Tehnološki procesi organske industrije Izv. prof. dr. sc. Hrvoje Kušić PROCES HALOGENIRANJA Proces kojim se
Fakultet kemijskog inženjerstva i tehnologije Diplomski studij: Kemijsko inženjerstvo Kolegij: Tehnološki procesi organske industrije Izv. prof. dr. sc. Hrvoje Kušić PROCES HALOGENIRANJA Proces kojim se
Microsoft Word - Test 2009 I.doc
 Ime i prezime (ŠTAMPANIM SLOVIMA!!!) jedinstveni matični broj građana (prepisati iz lične karte) broj prijave Test za prijemni ispit iz hemije 1. Hemijska promena je: a) rastvaranje NaCl b) sublimacija
Ime i prezime (ŠTAMPANIM SLOVIMA!!!) jedinstveni matični broj građana (prepisati iz lične karte) broj prijave Test za prijemni ispit iz hemije 1. Hemijska promena je: a) rastvaranje NaCl b) sublimacija
KEM KEMIJA Ispitna knjižica 2 OGLEDNI ISPIT KEM IK-2 OGLEDNI ISPIT 12 1
 KEM KEMIJA Ispitna knjižica 2 OGLEDNI ISPIT 2 Prazna stranica 99 2 OPĆE UPUTE Pozorno pročitajte sve upute i slijedite ih. Ne okrećite stranicu i ne rješavajte zadatke dok to ne odobri dežurni nastavnik.
KEM KEMIJA Ispitna knjižica 2 OGLEDNI ISPIT 2 Prazna stranica 99 2 OPĆE UPUTE Pozorno pročitajte sve upute i slijedite ih. Ne okrećite stranicu i ne rješavajte zadatke dok to ne odobri dežurni nastavnik.
Alkeni ili olefini – CnH2n
 ALKENI ili olefini C n H 2n Sadrže dvostruku C=C vezu Važan strukturni elemenat i funkcionalna grupa u organskoj hemiji Oblik molekule uvjetovan je prisustvom ove veze Dvostruka veza je mjesto na kojem
ALKENI ili olefini C n H 2n Sadrže dvostruku C=C vezu Važan strukturni elemenat i funkcionalna grupa u organskoj hemiji Oblik molekule uvjetovan je prisustvom ove veze Dvostruka veza je mjesto na kojem
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE I
 Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 009. PISANA
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 009. PISANA
ZADACI_KEMIJA_2008_1_A
 RAZREDBENI ISPIT 2008. (GRUPA A) ŠIFRA: Rješenje svakog zadatka treba označiti u Tablici s rješenjima znakom «X». U svakom zadatku samo je jedan predloženi odgovor točan. Svaki točno riješeni zadatak donosi
RAZREDBENI ISPIT 2008. (GRUPA A) ŠIFRA: Rješenje svakog zadatka treba označiti u Tablici s rješenjima znakom «X». U svakom zadatku samo je jedan predloženi odgovor točan. Svaki točno riješeni zadatak donosi
Regionalno_test_VIII_2013_hemija
 РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕГИОНАЛНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ (7. април 2013. године) ТЕСТ ЗНАЊА ЗА VIII РАЗРЕД Шифра ученика: Пажљиво прочитај
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕГИОНАЛНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ (7. април 2013. године) ТЕСТ ЗНАЊА ЗА VIII РАЗРЕД Шифра ученика: Пажљиво прочитај
Diapositive 1
 Karbonilni spojevi aldehidi i ketoni snove organske hemije Karbonilna jedinjenja aldehidi i ketoni Aldehidi i ketoni organska jedinjenja koja u svojoj strukturi sadrže karbonilnu grupu karbonilna jedinjenja:
Karbonilni spojevi aldehidi i ketoni snove organske hemije Karbonilna jedinjenja aldehidi i ketoni Aldehidi i ketoni organska jedinjenja koja u svojoj strukturi sadrže karbonilnu grupu karbonilna jedinjenja:
Chapter 23
 Poglavlje 23: Estarski enolati i Claisen-ova kondenzacija Podsećanje: aldolna kondenzacija Claisen-ova kondenzacija Kiseo proton Mehanizam: Adicija-eliminacija 1. korak: formiranje estarskog enolata Alkoksid
Poglavlje 23: Estarski enolati i Claisen-ova kondenzacija Podsećanje: aldolna kondenzacija Claisen-ova kondenzacija Kiseo proton Mehanizam: Adicija-eliminacija 1. korak: formiranje estarskog enolata Alkoksid
Microsoft PowerPoint - Šesti tjedan.pptx
 REKCIJSKO INŽENJERSTVO I KTLIZ KINETIK i MEHNIZM HOMOGENO KTLITIČKIH REKCIJ Vanja Kosar, izv. prof. Kod homogene katalize, reaktanti, produkti i katalizator nalaze se u istom agregatnom stanju Brzina homogeno
REKCIJSKO INŽENJERSTVO I KTLIZ KINETIK i MEHNIZM HOMOGENO KTLITIČKIH REKCIJ Vanja Kosar, izv. prof. Kod homogene katalize, reaktanti, produkti i katalizator nalaze se u istom agregatnom stanju Brzina homogeno
Katolički školski centar Sv. Josip Sarajevo Srednja medicinska škola ISPITNI KATALOG ZA ZAVRŠNI ISPIT IZ KEMIJE U ŠKOLSKOJ / GODINI Predme
 Katolički školski centar Sv. Josip Sarajevo Srednja medicinska škola ISPITNI KATALOG ZA ZAVRŠNI ISPIT IZ KEMIJE U ŠKOLSKOJ 2017. / 2018. GODINI Predmetno povjerenstvo za kemiju: Antonija Almaš - Ivković,
Katolički školski centar Sv. Josip Sarajevo Srednja medicinska škola ISPITNI KATALOG ZA ZAVRŠNI ISPIT IZ KEMIJE U ŠKOLSKOJ 2017. / 2018. GODINI Predmetno povjerenstvo za kemiju: Antonija Almaš - Ivković,
Prezentacja programu PowerPoint
 Aromatski ugljikovodici benzen Vanilin je esencijalna komponenta ulja vanilije dobivenog iz orhideje Vanilla fragrans. To je drugi najskuplji začin (poslije šafrana) Benzaldehid (iz višanja, breskvi,
Aromatski ugljikovodici benzen Vanilin je esencijalna komponenta ulja vanilije dobivenog iz orhideje Vanilla fragrans. To je drugi najskuplji začin (poslije šafrana) Benzaldehid (iz višanja, breskvi,
PowerPoint Presentation
 OSNOVE ORGANSKE HEMIJE Šta je to organska hemija i zašto je proučavamo Organska hemija ili Svijet ugljika/karbona Organske supstance (npr. maslinovo ulje, šeder, škrob, svila, guma, papir, penicilin )
OSNOVE ORGANSKE HEMIJE Šta je to organska hemija i zašto je proučavamo Organska hemija ili Svijet ugljika/karbona Organske supstance (npr. maslinovo ulje, šeder, škrob, svila, guma, papir, penicilin )
Министарство просвете, науке и технолошког развоја ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 22. април године ТЕСТ ЗА 8. РАЗРЕД Шифра ученика Српско хемијско
 Министарство просвете, науке и технолошког развоја ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 22. април 2018. године ТЕСТ ЗА 8. РАЗРЕД Шифра ученика Српско хемијско друштво (три слова и три броја) УПИШИ Х ПОРЕД НАВЕДЕНЕ
Министарство просвете, науке и технолошког развоја ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 22. април 2018. године ТЕСТ ЗА 8. РАЗРЕД Шифра ученика Српско хемијско друштво (три слова и три броја) УПИШИ Х ПОРЕД НАВЕДЕНЕ
Pretvorba metana u metanol korištenjem metalnih oksida
 PRETVORBA METANA U METANOL KORIŠTENJEM METALNIH OKSIDA Ružica Tomašević Kolegij: Anorganski reakcijski mehanizmi Asistent: mag. chem. Vinko Nemec Nositelj kolegija: doc. dr. sc. Vladimir Stilinović 11.
PRETVORBA METANA U METANOL KORIŠTENJEM METALNIH OKSIDA Ružica Tomašević Kolegij: Anorganski reakcijski mehanizmi Asistent: mag. chem. Vinko Nemec Nositelj kolegija: doc. dr. sc. Vladimir Stilinović 11.
Microsoft Word - Vježba 5.
 5. MASTI I ULJA Pokus 1. ODREĐIVANJE JODNOG BROJA MASLINOVOG I SUNCOKRETOVOG ULJA Jodni broj izražava u postotcima onu količinu joda koju može vezati adicijom neka mast (ulje) ili masna kiselina. Nezasićene
5. MASTI I ULJA Pokus 1. ODREĐIVANJE JODNOG BROJA MASLINOVOG I SUNCOKRETOVOG ULJA Jodni broj izražava u postotcima onu količinu joda koju može vezati adicijom neka mast (ulje) ili masna kiselina. Nezasićene
Diapositive 1
 KARBNILNI SPJEVI Najvažnija funkcionalna grupa u organskoj hemiji c o Aldehidi i ketoni Zastupljeni su u prirodi Doprinose ukusu i mirisu hrane Pomožu djelovanju mnogih enzima Koriste se kao reagensi i
KARBNILNI SPJEVI Najvažnija funkcionalna grupa u organskoj hemiji c o Aldehidi i ketoni Zastupljeni su u prirodi Doprinose ukusu i mirisu hrane Pomožu djelovanju mnogih enzima Koriste se kao reagensi i
Microsoft Word - VIII_P2_za_eskolu.doc
 POSEBNA NAPOMENA: Ispravljanje i bodovanje učeničkih odgovora u ovom pokusu provedeno je na specifičan način s obzirom da su neka pitanja ispitivala sposobnost primjene usvojenog znanja u neuobičajenim
POSEBNA NAPOMENA: Ispravljanje i bodovanje učeničkih odgovora u ovom pokusu provedeno je na specifičan način s obzirom da su neka pitanja ispitivala sposobnost primjene usvojenog znanja u neuobičajenim
Diapositive 1
 KARBOHIDROGENI (UGLJIKOVODICI) ALIFATSKI AROMATSKI CIKLIČKI ACIKLIČKI ALKANI ALKENI ALKINI Alkani Sadrže samo C i H Opća formula C n H 2n+2 Svi C atomi su sp 3 hibridizirani U molekulama se nalaze samo
KARBOHIDROGENI (UGLJIKOVODICI) ALIFATSKI AROMATSKI CIKLIČKI ACIKLIČKI ALKANI ALKENI ALKINI Alkani Sadrže samo C i H Opća formula C n H 2n+2 Svi C atomi su sp 3 hibridizirani U molekulama se nalaze samo
Microsoft PowerPoint - Prvi tjedan [Compatibility Mode]
![Microsoft PowerPoint - Prvi tjedan [Compatibility Mode] Microsoft PowerPoint - Prvi tjedan [Compatibility Mode]](/thumbs/99/139589070.jpg) REAKTORI I BIOREAKTORI PODJELA I OSNOVNI TIPOVI KEMIJSKIH REAKTORA Vanja Kosar, izv. prof. KEMIJSKI REAKTOR I KEMIJSKO RAKCIJSKO INŽENJERSTVO PODJELA REAKTORA I OPĆE BILANCE TVARI i TOPLINE 2 Kemijski
REAKTORI I BIOREAKTORI PODJELA I OSNOVNI TIPOVI KEMIJSKIH REAKTORA Vanja Kosar, izv. prof. KEMIJSKI REAKTOR I KEMIJSKO RAKCIJSKO INŽENJERSTVO PODJELA REAKTORA I OPĆE BILANCE TVARI i TOPLINE 2 Kemijski
Prezentacja programu PowerPoint
 Aromatski ugljikovodici benzen II dio Karakterističan tip reakcije benzena i njegovih derivata. Benzen podliježe reakciji supstitucije u prisustvu elektrofilne čestice ("+" naelektrisana čestica kod koje
Aromatski ugljikovodici benzen II dio Karakterističan tip reakcije benzena i njegovih derivata. Benzen podliježe reakciji supstitucije u prisustvu elektrofilne čestice ("+" naelektrisana čestica kod koje
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун
 РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун 2014. године ТЕСТ ЗНАЊА ЗА VIII РАЗРЕД Шифра ученика
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун 2014. године ТЕСТ ЗНАЊА ЗА VIII РАЗРЕД Шифра ученика
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEM
 Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učeni(ka)ca osnovnih i srednjih škola 2013. PISANA
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učeni(ka)ca osnovnih i srednjih škola 2013. PISANA
Slide 1
 Utjecaj ciljane gnojidbe na povećanje randmana i kvalitativna svojstva maslinovog ulja. 4. FESTIVAL MASLINA Zagreb, 23.-24. veljače 2019. Autorica: mr.sc. Sanja Biškup MINERALNA GNOJIVA nastaju od prirodnih
Utjecaj ciljane gnojidbe na povećanje randmana i kvalitativna svojstva maslinovog ulja. 4. FESTIVAL MASLINA Zagreb, 23.-24. veljače 2019. Autorica: mr.sc. Sanja Biškup MINERALNA GNOJIVA nastaju od prirodnih
PowerPoint Presentation
 ŠTA JE TO ORGANSKA HEMIJA I ZAŠTO JE PROUČAVAMO? ORGANSKO-PRIRODNO- HEMIJSKO-HEMIKALIJA? Organska hemija ili Svijet karbona Organske supstance (npr. maslinovo ulje, šećer, škrob, svila, guma, papir, penicilin
ŠTA JE TO ORGANSKA HEMIJA I ZAŠTO JE PROUČAVAMO? ORGANSKO-PRIRODNO- HEMIJSKO-HEMIKALIJA? Organska hemija ili Svijet karbona Organske supstance (npr. maslinovo ulje, šećer, škrob, svila, guma, papir, penicilin
Univerzitet u Nišu Prirodno-matematički fakultet Departman za hemiju Prijemni ispit za upis na Osnovne akademske studije hemije na PMF-u u Nišu školsk
 Univerzitet u Nišu Prirodno-matematički fakultet Departman za hemiju Prijemni ispit za upis na Osnovne akademske studije hemije na PMF-u u Nišu školske 2019/20. godine Test se popunjava zaokruživanjem
Univerzitet u Nišu Prirodno-matematički fakultet Departman za hemiju Prijemni ispit za upis na Osnovne akademske studije hemije na PMF-u u Nišu školske 2019/20. godine Test se popunjava zaokruživanjem
Zadaci
 Hemijski fakultet Univerziteta u Beogradu Prijemni ispit, 30. jun 2013. godine Test iz hemije Ime i prezime:. Redni broj prijave:. Napomena: Test raditi isključivo plavom ili crnom hemijskom olovkom. Vreme
Hemijski fakultet Univerziteta u Beogradu Prijemni ispit, 30. jun 2013. godine Test iz hemije Ime i prezime:. Redni broj prijave:. Napomena: Test raditi isključivo plavom ili crnom hemijskom olovkom. Vreme
ANALITIČKA KEMIJA SEMINAR
 SMINAR IZ KOLGIJA ANALITIČKA KMIJA I Studij Primijenjena kemija 1. Izračunajte potenijale sistema H AsO H AsO pri ph 1 i ph 6 u trenutku kada su konentraije oksidiranog i reduiranog oblika izjednačene!
SMINAR IZ KOLGIJA ANALITIČKA KMIJA I Studij Primijenjena kemija 1. Izračunajte potenijale sistema H AsO H AsO pri ph 1 i ph 6 u trenutku kada su konentraije oksidiranog i reduiranog oblika izjednačene!
NEURONAL
 NEW IRON PROIZVODI : MEDICINALIS D.O.O. ODGOVORAN ZA RH : D.O.O. NEW IRON SASTOJCI PROIZVODI : MEDICINALIS D.O.O. ODGOVORAN ZA RH : D.O.O. KELATI (prema grč. pandža) Kelati su kompleksni spojevi u kojima
NEW IRON PROIZVODI : MEDICINALIS D.O.O. ODGOVORAN ZA RH : D.O.O. NEW IRON SASTOJCI PROIZVODI : MEDICINALIS D.O.O. ODGOVORAN ZA RH : D.O.O. KELATI (prema grč. pandža) Kelati su kompleksni spojevi u kojima
Narodne novine, broj 162/98. i 107/07. ZAKON O LISTI PROFESIONALNIH BOLESTI (neslužbeno pročišćeni tekst) Članak 1. Ovim se Zakonom utvrđuju bolesti k
 Narodne novine, broj 162/98. i 107/07. ZAKON O LISTI PROFESIONALNIH BOLESTI (neslužbeno pročišćeni tekst) Članak 1. Ovim se Zakonom utvrđuju bolesti koje se, prema članku 38. stavku 1. Zakona o mirovinskom
Narodne novine, broj 162/98. i 107/07. ZAKON O LISTI PROFESIONALNIH BOLESTI (neslužbeno pročišćeni tekst) Članak 1. Ovim se Zakonom utvrđuju bolesti koje se, prema članku 38. stavku 1. Zakona o mirovinskom
ALKALITET VODE (p i m-vrijednost) Ukupnu tvrdoću sačinjavaju sve kalcijeve i magnezijeve soli sadržane u vodi u obliku karbonata, hidrogenkarbonata, k
 ALKALITET VODE (p i m-vrijednost) Ukupnu tvrdoću sačinjavaju sve kalcijeve i magnezijeve soli sadržane u vodi u obliku karbonata, hidrogenkarbonata, klorida, sulfata, nitrata, silikata, fosfata i dr. Iz
ALKALITET VODE (p i m-vrijednost) Ukupnu tvrdoću sačinjavaju sve kalcijeve i magnezijeve soli sadržane u vodi u obliku karbonata, hidrogenkarbonata, klorida, sulfata, nitrata, silikata, fosfata i dr. Iz
Osnove organske hemije Alkeni, nomenklatura, dobivanje i reakcije
 Osnove organske hemije Alkeni, nomenklatura, dobivanje i reakcije Opšta formula C n H 2n Nastavak je en Alkeni Funkcionalna grupa: C=C veza. Nezasićeni ugljikovodici podliježu reakcijama adicije. Prvi
Osnove organske hemije Alkeni, nomenklatura, dobivanje i reakcije Opšta formula C n H 2n Nastavak je en Alkeni Funkcionalna grupa: C=C veza. Nezasićeni ugljikovodici podliježu reakcijama adicije. Prvi
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa
 Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učeni(ka)ca osnovnih i srednjih škola 2011. PISANA
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i športa Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učeni(ka)ca osnovnih i srednjih škola 2011. PISANA
MINISTARSTVO ZAŠTITE OKOLIŠA I PRIRODE 1746 Na temelju članka 29. stavka 2. Zakona o zaštiti zraka (»Narodne novine«, br. 130/2011, 47/2014), ministar
 INISTARSTVO ZAŠTITE OKOLIŠA I PRIRODE 1746 Na temelju članka 29. stavka 2. Zakona o zaštiti zraka (»Narodne novine«, br. 130/2011, 47/2014), ministar zaštite okoliša i prirode donosi PROGRA JERENJA RAZINE
INISTARSTVO ZAŠTITE OKOLIŠA I PRIRODE 1746 Na temelju članka 29. stavka 2. Zakona o zaštiti zraka (»Narodne novine«, br. 130/2011, 47/2014), ministar zaštite okoliša i prirode donosi PROGRA JERENJA RAZINE
ENERGETSKI_SUSTAVI_P11_Energetski_sustavi_dizalice_topline_2
 ENERGETSKI SUSTAVI DIZALICE TOPLINE (Toplinske pumpe) ENERGETSKI TOK ZA DIZALICE TOPLINE (TOPLINSKE PUMPE) ENERGETSKI SUSTAVI 2 DIZALICE TOPLINE (TOPLINSKE PUMPE) DIZALICE TOPLINE koriste se za prijenos
ENERGETSKI SUSTAVI DIZALICE TOPLINE (Toplinske pumpe) ENERGETSKI TOK ZA DIZALICE TOPLINE (TOPLINSKE PUMPE) ENERGETSKI SUSTAVI 2 DIZALICE TOPLINE (TOPLINSKE PUMPE) DIZALICE TOPLINE koriste se za prijenos
1 Vježba 11. ENERGETSKE PROMJENE PRI OTAPANJU SOLI. OVISNOST TOPLJIVOSTI O TEMPERATURI. Uvod: Prilikom otapanja soli u nekom otapalu (najčešće je to v
 1 Vježba 11. ENERGETSKE PROMJENE PRI OTAPANJU SOLI. OVISNOST TOPLJIVOSTI O TEMPERATURI. Uvod: Prilikom otapanja soli u nekom otapalu (najčešće je to voda) istodobno se odvijaju dva procesa. Prvi proces
1 Vježba 11. ENERGETSKE PROMJENE PRI OTAPANJU SOLI. OVISNOST TOPLJIVOSTI O TEMPERATURI. Uvod: Prilikom otapanja soli u nekom otapalu (najčešće je to voda) istodobno se odvijaju dva procesa. Prvi proces
6-STRUKTURA MOLEKULA_v2018
 ELEKTRNSKE STRUKTURNE FRMULE SADRŽAJ: 1. LEWISVE STRUKTURE 1.1. koraci u crtanju Lewisovih struktura 1.2. odstupanje od pravila okteta 2. GEMETRIJA MLEKULA 2.1. uvod 2.2. koraci u riješavanju problema
ELEKTRNSKE STRUKTURNE FRMULE SADRŽAJ: 1. LEWISVE STRUKTURE 1.1. koraci u crtanju Lewisovih struktura 1.2. odstupanje od pravila okteta 2. GEMETRIJA MLEKULA 2.1. uvod 2.2. koraci u riješavanju problema
MEDICINSKI FAKULTET SVEUČILIŠTA U MOSTARU DIPLOMSKI SVEUČILIŠNI STUDIJ MEDICINE Kolegij: Medicinska kemija Nositeljica kolegija: prof. dr. sc. Zora Pi
 MEDICINSKI FAKULTET SVEUČILIŠTA U MOSTARU DIPLOMSKI SVEUČILIŠNI STUDIJ MEDICINE Kolegij: Medicinska kemija Nositeljica kolegija: prof. dr. sc. Zora Pilić Godina: I Semestar: II ECTS Razina kolegija: Osnovna
MEDICINSKI FAKULTET SVEUČILIŠTA U MOSTARU DIPLOMSKI SVEUČILIŠNI STUDIJ MEDICINE Kolegij: Medicinska kemija Nositeljica kolegija: prof. dr. sc. Zora Pilić Godina: I Semestar: II ECTS Razina kolegija: Osnovna
Савез хемичара и технолога Македоније Такмичења из хемије за ученике основних и средњих школа ШИФРА: (уноси комисија по завршетку тестирања овде и на
 Савез хемичара и технолога Македоније Такмичења из хемије за ученике основних и средњих школа ШИФРА: (уноси комисија по завршетку тестирања овде и на коверту) ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 6 април, 2019
Савез хемичара и технолога Македоније Такмичења из хемије за ученике основних и средњих школа ШИФРА: (уноси комисија по завршетку тестирања овде и на коверту) ОКРУЖНО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ 6 април, 2019
MEHANIZAM DJELOVANJA ALKOHOL DEHIDROGENAZE
 MEHANIZAM DJELOVANJA ALKOHOL DEHIDROGENAZE Viktorija Medvarić Skupina oksidoreduktaza (E.C. 1.1.1.1) Koenzim NAD(P)H Interkonverzija alkohola u aldehid/keton U arhejama, bakterijama i eukariotima Tip I,
MEHANIZAM DJELOVANJA ALKOHOL DEHIDROGENAZE Viktorija Medvarić Skupina oksidoreduktaza (E.C. 1.1.1.1) Koenzim NAD(P)H Interkonverzija alkohola u aldehid/keton U arhejama, bakterijama i eukariotima Tip I,
Microsoft PowerPoint - SSA_seminar_1_dio [Compatibility Mode]
![Microsoft PowerPoint - SSA_seminar_1_dio [Compatibility Mode] Microsoft PowerPoint - SSA_seminar_1_dio [Compatibility Mode]](/thumbs/100/146475485.jpg) Spektroskopska k k strukturna analiza seminar 1dio 1. nositelj: prof. dr. sc. Predrag Novak održao i sastavio: doc. dr. sc. Tomislav Jednačak; ak. god. 2018./19. Područja kemijskog pomaka signala u 1 H
Spektroskopska k k strukturna analiza seminar 1dio 1. nositelj: prof. dr. sc. Predrag Novak održao i sastavio: doc. dr. sc. Tomislav Jednačak; ak. god. 2018./19. Područja kemijskog pomaka signala u 1 H
ALKOHOLI
 ALKLI Hidroksilna grupa vezana na zasićeni sp 3 hibridizirani C-atom C C C Alkohol Fenol Enol Alkoholi u prirodi CH 3 CH 3 CH 2 Etanol CH3 Metanol CH 3 CH 3 Mentol (iz pepermint ulja) Izoprenska jedinica
ALKLI Hidroksilna grupa vezana na zasićeni sp 3 hibridizirani C-atom C C C Alkohol Fenol Enol Alkoholi u prirodi CH 3 CH 3 CH 2 Etanol CH3 Metanol CH 3 CH 3 Mentol (iz pepermint ulja) Izoprenska jedinica
BS-predavanje-3-plinovi-krutine-tekucine
 STRUKTURA ČISTIH TVARI Pojam temperature Porastom temperature raste brzina gibanja plina, osciliranje atoma i molekula u kristalu i tekućini Temperatura izražava intenzivnost gibanja atoma i molekula u
STRUKTURA ČISTIH TVARI Pojam temperature Porastom temperature raste brzina gibanja plina, osciliranje atoma i molekula u kristalu i tekućini Temperatura izražava intenzivnost gibanja atoma i molekula u
PowerPoint Presentation
 Anorganski reakcijski mehanizmi: klasifikacija Nino Jukić 14. svibnja 2019. Sadržaj Što je mehanizam? razvoj reakcijskih mehanizama kroz povijest (općenito i anorganska kemija) elementi glavnih skupina
Anorganski reakcijski mehanizmi: klasifikacija Nino Jukić 14. svibnja 2019. Sadržaj Što je mehanizam? razvoj reakcijskih mehanizama kroz povijest (općenito i anorganska kemija) elementi glavnih skupina
Broj: /17 Zagreb, SVEUČILIŠTE U ZAGREBU AGRONOMSKI FAKULTET Oznaka: OB-022 ZAVOD ZA ISHRANU BILJA Izdanje: 02 ANALITIČKI LABORATORIJ
 Stranica: 1/6 VODOVOD I KAALIZACIJA d.o.o. Ogulin, I.G. Kovačića 14 47300 OGULI Rezultati kemijske analize mulja sa uređaja za pročišćavanje otpadnih voda grada Ogulina Poštovani, provedena je kemijska
Stranica: 1/6 VODOVOD I KAALIZACIJA d.o.o. Ogulin, I.G. Kovačića 14 47300 OGULI Rezultati kemijske analize mulja sa uređaja za pročišćavanje otpadnih voda grada Ogulina Poštovani, provedena je kemijska
Naknade za poslove Centra za vinogradarstvo, vinarstvo i uljarstvo koje su propisane pravilnikom Redni broj NAZIV PROPISA broj Narodnih Novina 1. Prav
 Naknade za poslove Centra za vinogradarstvo, vinarstvo i uljarstvo koje su propisane pravilnikom Redni broj NAZIV PROPISA broj Narodnih Novina 1. Pravilnik o visini naknade troškova za obavljanje usluga
Naknade za poslove Centra za vinogradarstvo, vinarstvo i uljarstvo koje su propisane pravilnikom Redni broj NAZIV PROPISA broj Narodnih Novina 1. Pravilnik o visini naknade troškova za obavljanje usluga
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун
 РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун 2014. године ТЕСТ ЗНАЊА ЗА VII РАЗРЕД Шифра ученика
РЕПУБЛИКА СРБИЈА МИНИСТАРСТВО ПРОСВЕТЕ, НАУКЕ И ТЕХНОЛОШКОГ РАЗВОЈА СРПСКО ХЕМИЈСКО ДРУШТВО РЕПУБЛИЧКО ТАКМИЧЕЊЕ ИЗ ХЕМИЈЕ Лесковац, 31. мај и 1. јун 2014. године ТЕСТ ЗНАЊА ЗА VII РАЗРЕД Шифра ученика
Title Layout
 Optimizacija hidrotermalne metode za sintezu trostrukih perovskita tipa Sr 3 Mn 2 (W/Te)O 9 The Optimization of Hydrothermal Method for the Synthesis of Triple Perovskites with a Sr 3 Mn 2 (W/Te)O 9 Structure
Optimizacija hidrotermalne metode za sintezu trostrukih perovskita tipa Sr 3 Mn 2 (W/Te)O 9 The Optimization of Hydrothermal Method for the Synthesis of Triple Perovskites with a Sr 3 Mn 2 (W/Te)O 9 Structure
ZBRINJAVANJE POLIMERNOG OTPADA
 Sveučilište u Zagrebu Fakultet kemijskog inženjerstva i tehnologije ZBRINJAVANJE POLIMERNOG OTPADA Studij: EKOINŽENJERSTVO Predmetni nastavnik: Dr. sc. Zlata Hrnjak Murgić, red. prof. zhrnjak@fkit.hr Energetski
Sveučilište u Zagrebu Fakultet kemijskog inženjerstva i tehnologije ZBRINJAVANJE POLIMERNOG OTPADA Studij: EKOINŽENJERSTVO Predmetni nastavnik: Dr. sc. Zlata Hrnjak Murgić, red. prof. zhrnjak@fkit.hr Energetski
ФАКУЛТЕТ ТЕХНИЧКИХ НАУКА ОДСЕК ЗА ПРОИЗВОДНО МАШИНСТВО ПРОЈЕКТОВАЊЕ ТЕХНОЛОГИЈЕ ТЕРМИЧКЕ ОБРАДЕ ХЕМИЈСКО ДЕЈСТВО ОКОЛИНЕ У ПРОЦЕСИМА ТЕРМИЧКЕ ОБРАДЕ -
 ФАКУЛТЕТ ТЕХНИЧКИХ НАУКА ОДСЕК ЗА ПРОИЗВОДНО МАШИНСТВО ПРОЈЕКТОВАЊЕ ТЕХНОЛОГИЈЕ ТЕРМИЧКЕ ОБРАДЕ ХЕМИЈСКО ДЕЈСТВО ОКОЛИНЕ У ПРОЦЕСИМА ТЕРМИЧКЕ ОБРАДЕ - РАДНО - ПРИРЕДИО: ДОЦ. ДР АЛЕКСАНДАР МИЛЕТИЋ SADRŽAJ
ФАКУЛТЕТ ТЕХНИЧКИХ НАУКА ОДСЕК ЗА ПРОИЗВОДНО МАШИНСТВО ПРОЈЕКТОВАЊЕ ТЕХНОЛОГИЈЕ ТЕРМИЧКЕ ОБРАДЕ ХЕМИЈСКО ДЕЈСТВО ОКОЛИНЕ У ПРОЦЕСИМА ТЕРМИЧКЕ ОБРАДЕ - РАДНО - ПРИРЕДИО: ДОЦ. ДР АЛЕКСАНДАР МИЛЕТИЋ SADRŽAJ
Energija
 Mali obrazovni priručnik Riječ energija nastala je od grčke riječi energos što znači aktivnost. Energija je uzrok svemu što se događa oko nas. Sve što nas okružuje zasnovano je na korištenju energije.
Mali obrazovni priručnik Riječ energija nastala je od grčke riječi energos što znači aktivnost. Energija je uzrok svemu što se događa oko nas. Sve što nas okružuje zasnovano je na korištenju energije.
KARBOKSILNE KISELINE
 Najvažnije nezasićene dikarbonske kiseline su maleinska i fumarna kiselina kao klasični primjeri geometrijske izomerije tzv. cis- i transizomerija: H C HC C H H C H C cis-maleinska kiselina trans-fumarna
Najvažnije nezasićene dikarbonske kiseline su maleinska i fumarna kiselina kao klasični primjeri geometrijske izomerije tzv. cis- i transizomerija: H C HC C H H C H C cis-maleinska kiselina trans-fumarna
PROVEDBENA UREDBA KOMISIJE (EU) 2018/ оd 23. srpnja o odobrenju bakar(II) diacetat monohidrata, bakar(II) karbonat dihi
 24.7.2018. HR L 186/3 PROVEDBENA UREDBA KOMISIJE (EU) 2018/1039 оd 23. srpnja 2018. o orenju bakar(ii) diacetat monohidrata, bakar(ii) karbonat dihidroksi monohidrata, bakar(ii) klorid dihidrata, bakar(ii)
24.7.2018. HR L 186/3 PROVEDBENA UREDBA KOMISIJE (EU) 2018/1039 оd 23. srpnja 2018. o orenju bakar(ii) diacetat monohidrata, bakar(ii) karbonat dihidroksi monohidrata, bakar(ii) klorid dihidrata, bakar(ii)
Slide 1
 UGRADNJA DeNOx POSTROJENJA U TE PLOMIN 2 Autor: Ivica Vukelić HEP Proizvodnja d.o.o. / Sektor za TE Ivica.Vukelic@hep.hr 1 NOx SPOJEVI ŠTO JE TO? - niz spojeva dušika i kisika opće formule NOx NASTANAK
UGRADNJA DeNOx POSTROJENJA U TE PLOMIN 2 Autor: Ivica Vukelić HEP Proizvodnja d.o.o. / Sektor za TE Ivica.Vukelic@hep.hr 1 NOx SPOJEVI ŠTO JE TO? - niz spojeva dušika i kisika opće formule NOx NASTANAK
KAPLJEVINE KARBOKSILNE KISELINE 661 dimenzija (čvrsti sol), a moguće je i izokoloidno stanje kad su i dispergirane čestice i disperzijsko sredstvo ist
 KAPLJEVNE KARBOKSLNE KSELNE 661 dimenzija (čvrsti sol), a moguće je i izokoloidno stanje kad su i dispergirane čestice i disperzijsko sredstvo istog kemijskog sastava, ali zbog nedovoljno sređene strukture
KAPLJEVNE KARBOKSLNE KSELNE 661 dimenzija (čvrsti sol), a moguće je i izokoloidno stanje kad su i dispergirane čestice i disperzijsko sredstvo istog kemijskog sastava, ali zbog nedovoljno sređene strukture
Slide 1
 MEĐUNARODNO SAVJETOVANJE I RADIONICA IZAZOVI STRATEGIJE ZAŠTITE OKOLIŠA I ODRŽIVOG RAZVOJA 29. 9. 2005. Izborom tehnologije zbrinjavanja otpada do zaštite okoliša i novih vrijednosti Dr. sc. Slaven Dobrović
MEĐUNARODNO SAVJETOVANJE I RADIONICA IZAZOVI STRATEGIJE ZAŠTITE OKOLIŠA I ODRŽIVOG RAZVOJA 29. 9. 2005. Izborom tehnologije zbrinjavanja otpada do zaštite okoliša i novih vrijednosti Dr. sc. Slaven Dobrović
ПРЕДМЕТИ I ГОДИНЕ ЗАЈЕДНИЧКИ ЗА СВЕ СТУДИЈСКЕ ПРОГРАМЕ
 2014 ПРЕДМЕТИ I ГОДИНЕ ЗАЈЕДНИЧКИ ЗА СВЕ СТУДИЈСКЕ ПРОГРАМЕ ШИФРА ПРЕДМЕТИ I СЕМЕСТАР ЕСПБ ФОНД ЧАСОВ А ШИФРА ПРЕДМЕТИ II СЕМЕСТАР ЕСПБ ФОНД ЧАСОВА ЗП101 Општа хемија 1 7 60-30 ЗП111 7 60-30 14ЗП102 7
2014 ПРЕДМЕТИ I ГОДИНЕ ЗАЈЕДНИЧКИ ЗА СВЕ СТУДИЈСКЕ ПРОГРАМЕ ШИФРА ПРЕДМЕТИ I СЕМЕСТАР ЕСПБ ФОНД ЧАСОВ А ШИФРА ПРЕДМЕТИ II СЕМЕСТАР ЕСПБ ФОНД ЧАСОВА ЗП101 Општа хемија 1 7 60-30 ЗП111 7 60-30 14ЗП102 7
Microsoft Word - informator 2015-priprema.doc
 ИНФОРМАТОР 29 UNIVERZITET U BEOGRADU jun 2005. godine KLASIFIKACIONI ISPIT IZ HEMIJE ZA UPIS NA TEHNOLOŠKO-METALURŠKI FAKULTET U BEOGRADU Šifra zadatka: 51501 Test ima 20 pitanja. Netačan odgovor donosi
ИНФОРМАТОР 29 UNIVERZITET U BEOGRADU jun 2005. godine KLASIFIKACIONI ISPIT IZ HEMIJE ZA UPIS NA TEHNOLOŠKO-METALURŠKI FAKULTET U BEOGRADU Šifra zadatka: 51501 Test ima 20 pitanja. Netačan odgovor donosi
Slide 1
 Kompleksi Prelazni metali Međusobno imaju slične osobine Dosta se razlikuju od alkalih i zemnoalkalnih metala Imaju visoku tačku topljenja,veliku gustinu, uglavnom veliku tvrdoću, dobri su provodnici
Kompleksi Prelazni metali Međusobno imaju slične osobine Dosta se razlikuju od alkalih i zemnoalkalnih metala Imaju visoku tačku topljenja,veliku gustinu, uglavnom veliku tvrdoću, dobri su provodnici
Odjel za zdravstvenu ispravnost i kvalitetu hrane i predmeta opće uporabe Služba za zaštitu okoliša i zdravstvenu ekologiju Mirogojska cesta 16, Zagre
 Odjel za zdravstvenu ispravnost i kvalitetu hrane i predmeta opće uporabe Služba za zaštitu okoliša i zdravstvenu ekologiju Mirogojska cesta 16, Zagreb Tel. 01/4696 227, Fax. 01/4678 103 www.stampar.hr
Odjel za zdravstvenu ispravnost i kvalitetu hrane i predmeta opće uporabe Služba za zaštitu okoliša i zdravstvenu ekologiju Mirogojska cesta 16, Zagreb Tel. 01/4696 227, Fax. 01/4678 103 www.stampar.hr
OD MONOKRISTALNIH ELEKTRODA DO MODELÂ POVRŠINSKIH REAKCIJA
 UVOD U PRAKTIKUM FIZIKALNE KEMIJE TIN KLAČIĆ, mag. chem. Zavod za fizikalnu kemiju, 2. kat (soba 219) Kemijski odsjek Prirodoslovno-matematički fakultet Sveučilište u Zagrebu e-mail: tklacic@chem.pmf.hr
UVOD U PRAKTIKUM FIZIKALNE KEMIJE TIN KLAČIĆ, mag. chem. Zavod za fizikalnu kemiju, 2. kat (soba 219) Kemijski odsjek Prirodoslovno-matematički fakultet Sveučilište u Zagrebu e-mail: tklacic@chem.pmf.hr
Avokado – čarobno voće
 Kreni zdravo! Stranica o zdravim navikama i uravnoteženom životu https://www.krenizdravo.rtl.hr Avokado - čarobno voće Avokado je tropsko voće koje raste u Srednjoj Americi i Meksiku. Naziv avokado potječe
Kreni zdravo! Stranica o zdravim navikama i uravnoteženom životu https://www.krenizdravo.rtl.hr Avokado - čarobno voće Avokado je tropsko voće koje raste u Srednjoj Americi i Meksiku. Naziv avokado potječe
ZOB_Ekonomski_Model_Poticaja
 Sunčane ćelije treće generacije Andro Bačan, dipl.ing.el. Energetski institut Hrvoje Požar 10. Zagrebački energetski tjedan Seminar Hrvatske komore inženjere elektrotehnike Tehnološki park, Zagrebački
Sunčane ćelije treće generacije Andro Bačan, dipl.ing.el. Energetski institut Hrvoje Požar 10. Zagrebački energetski tjedan Seminar Hrvatske komore inženjere elektrotehnike Tehnološki park, Zagrebački
Microsoft PowerPoint - 4_Hemijska_korozija.ppt - Compatibility Mode
 KOROZIJA I ZAŠTITA METALA dr Aleksandar Lj. Bojić Hemijska korozija metala 1 Hemijska korozija: proces reagovanja metalne površine sa okolinom, kod koga je prelaz metala u jonsko stanje i redukcija oksidacione
KOROZIJA I ZAŠTITA METALA dr Aleksandar Lj. Bojić Hemijska korozija metala 1 Hemijska korozija: proces reagovanja metalne površine sa okolinom, kod koga je prelaz metala u jonsko stanje i redukcija oksidacione
Microsoft PowerPoint - NMRuvod [Compatibility Mode]
![Microsoft PowerPoint - NMRuvod [Compatibility Mode] Microsoft PowerPoint - NMRuvod [Compatibility Mode]](/thumbs/99/142728880.jpg) Nuklearna Magnetna Rezonancija NMR 1970.-1980. Dvodimenzijske metode i tehnike (2D NMR) POVIJESNI RAZVOJ NMR-a 1924. W. Pauli - teorijski temelji NMR 1939. Rabi i sur. - dokaz o postojanju nuklearnog spina
Nuklearna Magnetna Rezonancija NMR 1970.-1980. Dvodimenzijske metode i tehnike (2D NMR) POVIJESNI RAZVOJ NMR-a 1924. W. Pauli - teorijski temelji NMR 1939. Rabi i sur. - dokaz o postojanju nuklearnog spina
CVRSTOCA
 ČVRSTOĆA 12 TEORIJE ČVRSTOĆE NAPREGNUTO STANJE Pri analizi unutarnjih sila koje se pojavljuju u kosom presjeku štapa opterećenog na vlak ili tlak, pri jednoosnom napregnutom stanju, u tim presjecima istodobno
ČVRSTOĆA 12 TEORIJE ČVRSTOĆE NAPREGNUTO STANJE Pri analizi unutarnjih sila koje se pojavljuju u kosom presjeku štapa opterećenog na vlak ili tlak, pri jednoosnom napregnutom stanju, u tim presjecima istodobno
Toplinska i električna vodljivost metala
 Električna vodljivost metala Cilj vježbe Određivanje koeficijenta električne vodljivosti bakra i aluminija U-I metodom. Teorijski dio Eksperimentalno je utvrđeno da otpor ne-ohmskog vodiča raste s porastom
Električna vodljivost metala Cilj vježbe Određivanje koeficijenta električne vodljivosti bakra i aluminija U-I metodom. Teorijski dio Eksperimentalno je utvrđeno da otpor ne-ohmskog vodiča raste s porastom
Министарство просветe и спортa Републике Србије
 Министарство просветe и спортa Републике Србије Српско хемијско друштво Републичко такмичење из хемије 21.05.2005. Тест за I разред средње школе Име и презиме Место и школа Разред Не отварајте добијени
Министарство просветe и спортa Републике Србије Српско хемијско друштво Републичко такмичење из хемије 21.05.2005. Тест за I разред средње школе Име и презиме Место и школа Разред Не отварајте добијени
ZAVOD ZA JAVNO ZDRAVSTVO ISTARSKE ŽUPANIJE- ISTITUTO DI SANITÀ PUBBLICA DELLA REGIONE ISTRIANA PULA Nazorova 23 Pula, PRVI REBALANS PLANA N
 ZAVOD ZA JAVNO ZDRAVSTVO ISTARSKE ŽUPANIJE- ISTITUTO DI SANITÀ PUBBLICA DELLA REGIO ISTRIANA PULA Nazorova 23 Pula, 28.5. PRVI REBALANS PLANA NABAVE ZAVO ZA JAVNO ZDRAVSTVO ISTARSKE ŽUPANIJE ISTITUTO DI
ZAVOD ZA JAVNO ZDRAVSTVO ISTARSKE ŽUPANIJE- ISTITUTO DI SANITÀ PUBBLICA DELLA REGIO ISTRIANA PULA Nazorova 23 Pula, 28.5. PRVI REBALANS PLANA NABAVE ZAVO ZA JAVNO ZDRAVSTVO ISTARSKE ŽUPANIJE ISTITUTO DI
Republika Hrvatska Ministarstvo znanosti i obrazovanja Agencija za odgoj i obrazovanje Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učenika
 Republika Hrvatska Ministarstvo znanosti i obrazovanja Agencija za odgoj i obrazovanje Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 019. PISANA ZADAĆA NAPOMENA:
Republika Hrvatska Ministarstvo znanosti i obrazovanja Agencija za odgoj i obrazovanje Hrvatsko kemijsko društvo ŠKOLSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 019. PISANA ZADAĆA NAPOMENA:
Microsoft PowerPoint - 18 Rapid prototyping.ppt
 Rapid Prototyping doc.dr. Samir Lemeš Rapid Prototyping Osnovni pojmovi i upotreba Fused Deposition Modeling Selektivno lasersko sinterovanje Laminated Object Manufacturing Laser Engineered
Rapid Prototyping doc.dr. Samir Lemeš Rapid Prototyping Osnovni pojmovi i upotreba Fused Deposition Modeling Selektivno lasersko sinterovanje Laminated Object Manufacturing Laser Engineered
Bor, Srbija GEOLOGIJA MINERALNIH LEŽIŠTA Andrea Čobić
 Bor, Srbija GEOLOGIJA MINERALNIH LEŽIŠTA Andrea Čobić (ancobic@geol.pmf.hr) Sadržaj kolegija Ekonomski aspekt mineralnih ležišta Analitičke metode u istraživanjima mineralnih ležišta Teksture i strukture
Bor, Srbija GEOLOGIJA MINERALNIH LEŽIŠTA Andrea Čobić (ancobic@geol.pmf.hr) Sadržaj kolegija Ekonomski aspekt mineralnih ležišta Analitičke metode u istraživanjima mineralnih ležišta Teksture i strukture
464_Leistungserklärung
 Izjava o svojstvima prema Prilogu III Uredbe (EU) br. 305/2011 za proizvod Disboxid 464 EP-Decksiegel 1. Jedinstvena identifikacijska oznaka tipa proizvoda: EN 1504-2: ZA.1d, ZA.1f i ZA.1g EN 13813: SR
Izjava o svojstvima prema Prilogu III Uredbe (EU) br. 305/2011 za proizvod Disboxid 464 EP-Decksiegel 1. Jedinstvena identifikacijska oznaka tipa proizvoda: EN 1504-2: ZA.1d, ZA.1f i ZA.1g EN 13813: SR
Kvadrupolni maseni analizator, princip i primena u kvali/kvanti hromatografiji
 Kvadrupolni maseni analizator, princip i primena u kvali/kvanti hromatografiji doc dr Nenad Vuković, Institut za hemiju, Prirodno-matematički fakultet u Kragujevcu JONIZACIJA ELEKTRONSKIM UDAROM Joni u
Kvadrupolni maseni analizator, princip i primena u kvali/kvanti hromatografiji doc dr Nenad Vuković, Institut za hemiju, Prirodno-matematički fakultet u Kragujevcu JONIZACIJA ELEKTRONSKIM UDAROM Joni u
KATALOG PITANJA IZ HEMIJE ZA OSNOVNE ŠKOLE
 2018. KATALOG PITANJA IZ HEMIJE ZA OSNOVNE ŠKOLE PEDAGOŠKI ZAVOD TUZLANSKOG KANTONA TUZLA 1 BOSNA I HERCEGOVINA FEDERACIJA BOSNE I HERCEGOVINE TUZLANSKI KANTON PEDAGOŠKI ZAVOD TUZLANSKOG KANTONA - TUZLA
2018. KATALOG PITANJA IZ HEMIJE ZA OSNOVNE ŠKOLE PEDAGOŠKI ZAVOD TUZLANSKOG KANTONA TUZLA 1 BOSNA I HERCEGOVINA FEDERACIJA BOSNE I HERCEGOVINE TUZLANSKI KANTON PEDAGOŠKI ZAVOD TUZLANSKOG KANTONA - TUZLA
Прилог 7. Граничне вредности концентрације опасних компоненти у отпаду на основу којих се одређују карактеристике отпада (својства отпада која га кара
 Прилог 7. Граничне вредности концентрације опасних компоненти у отпаду на основу којих се одређују карактеристике отпада (својства отпада која га карактеришу као опасан отпад) H1 Експлозиван : Отпад класификован
Прилог 7. Граничне вредности концентрације опасних компоненти у отпаду на основу којих се одређују карактеристике отпада (својства отпада која га карактеришу као опасан отпад) H1 Експлозиван : Отпад класификован
5.8. Fosilna goriva Nafta je najvažniji izvor energije na Zemlji. Nastajala je milijunima godina i u njoj je pohranjena golema količina energije. Indu
 5.8. Fosilna goriva Nafta je najvažniji izvor energije na Zemlji. Nastajala je milijunima godina i u njoj je pohranjena golema količina energije. Industrijski razvijene zemlje svoju ekonomiju temelje na
5.8. Fosilna goriva Nafta je najvažniji izvor energije na Zemlji. Nastajala je milijunima godina i u njoj je pohranjena golema količina energije. Industrijski razvijene zemlje svoju ekonomiju temelje na
198 DEHIDRATACIJA DEHIDROGENACIJA taldehid, od kojega se jedan dio hidrogenira u etanol i onda po postupku Ostromyslenskog prevodi u butadien. Otpadni
 198 DEHIDRATACIJA DEHIDROGENACIJA taldehid, od kojega se jedan dio hidrogenira u etanol i onda po postupku Ostromyslenskog prevodi u butadien. Otpadni plinovi prerade metana iskorišćuju se za sintezu amonijaka.
198 DEHIDRATACIJA DEHIDROGENACIJA taldehid, od kojega se jedan dio hidrogenira u etanol i onda po postupku Ostromyslenskog prevodi u butadien. Otpadni plinovi prerade metana iskorišćuju se za sintezu amonijaka.
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE I
 Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 204. PISANA
Republika Hrvatska - Ministarstvo znanosti, obrazovanja i sporta - Agencija za odgoj i obrazovanje - Hrvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 204. PISANA
IPPC zahtev[1] [Compatibility Mode]
![IPPC zahtev[1] [Compatibility Mode] IPPC zahtev[1] [Compatibility Mode]](/thumbs/102/154561259.jpg) ПРИМЕНА IPPC ДИРЕКТИВЕ У СРБИЈИ ЗАХТЕВ ЗА ИЗДАВАЊЕ ИНТЕГРИСАНЕ ДОЗВОЛЕ qзакон о интегрисаном спречавању и контроли загађивања животне средине (Сл. Гласник РС, број 135/2004) Уређује услове и поступак издавања
ПРИМЕНА IPPC ДИРЕКТИВЕ У СРБИЈИ ЗАХТЕВ ЗА ИЗДАВАЊЕ ИНТЕГРИСАНЕ ДОЗВОЛЕ qзакон о интегрисаном спречавању и контроли загађивања животне средине (Сл. Гласник РС, број 135/2004) Уређује услове и поступак издавања
Microsoft Word - ZR_2017_JandrliÄ⁄_Martina_
 PRIRODOSLOVNO-MATEMATIČKI FAKULTET Kemijski odsjek Studentica 3. godine Preddiplomskog sveučilišnog studija KEMIJA Metode termičke analize u kemiji čvrstog stanja Rad je izrađen u Zavodu za opću i anorgansku
PRIRODOSLOVNO-MATEMATIČKI FAKULTET Kemijski odsjek Studentica 3. godine Preddiplomskog sveučilišnog studija KEMIJA Metode termičke analize u kemiji čvrstog stanja Rad je izrađen u Zavodu za opću i anorgansku
OŠ ŠIME BUDINIĆA - ZADAR
 OŠ ŠIME BUDINIĆA - ZADAR učenici: Petra Višić, Luka Rušev, Petra Marušić, Nina Bukulin mentor: Anita Mustać Zagreb, 15. 17. 3. 2019. SOL ZAČIN ŽIVOTA ISTRAŽILI SMO Sol značajna za ljudsku civilizaciju:
OŠ ŠIME BUDINIĆA - ZADAR učenici: Petra Višić, Luka Rušev, Petra Marušić, Nina Bukulin mentor: Anita Mustać Zagreb, 15. 17. 3. 2019. SOL ZAČIN ŽIVOTA ISTRAŽILI SMO Sol značajna za ljudsku civilizaciju:
Impress
 Mogu li se sudari super-ljuski vidjeti pomoću teleskopa LOFAR? Marta Čolaković-Bencerić1, Vibor Jelić2 Fizički odsjek, PMF, Sveučilište u Zagrebu, Bijenička cesta 32, 10000 Zagreb, Hrvatska 1 Institut
Mogu li se sudari super-ljuski vidjeti pomoću teleskopa LOFAR? Marta Čolaković-Bencerić1, Vibor Jelić2 Fizički odsjek, PMF, Sveučilište u Zagrebu, Bijenička cesta 32, 10000 Zagreb, Hrvatska 1 Institut
Mitohondriji i kloroplasti Stanično disanje Fotosinteza Evolucija metaboličkih reakcija
 Mitohondriji i kloroplasti Stanično disanje Fotosinteza Evolucija metaboličkih reakcija Proizvodnja i kontrola metaboličke energije središnja je aktivnost svake stanice i osnovni put metabolizma energije
Mitohondriji i kloroplasti Stanično disanje Fotosinteza Evolucija metaboličkih reakcija Proizvodnja i kontrola metaboličke energije središnja je aktivnost svake stanice i osnovni put metabolizma energije
Na temelju članka 45. stavka 5. Zakona o zaštiti na radu (»Narodne novine«, broj 71/14, 118/14 i 154/14), ministar nadležan za rad uz suglasnost minis
 Na temelju članka 45. stavka 5. Zakona o zaštiti na radu (»Narodne novine«, broj 71/14, 118/14 i 154/14), ministar nadležan za rad uz suglasnost ministra nadležnog za zdravlje donosi PRAVILNIK O ISPITIVANJU
Na temelju članka 45. stavka 5. Zakona o zaštiti na radu (»Narodne novine«, broj 71/14, 118/14 i 154/14), ministar nadležan za rad uz suglasnost ministra nadležnog za zdravlje donosi PRAVILNIK O ISPITIVANJU
PowerPoint Presentation
 Prečišćavanje otpadnih gasova Pregled SISTEMI ZA PREČIŠĆAVANJE OTPADNIH GASOVA SISTEMI ZA UKLANJANJE ČESTICA SISTEMI ZA UKLANJANJE GASOVITIH POLUTANATA 10 Emisija u svetu (Mt/god) CO VOCs SOx NOx ČESTICE
Prečišćavanje otpadnih gasova Pregled SISTEMI ZA PREČIŠĆAVANJE OTPADNIH GASOVA SISTEMI ZA UKLANJANJE ČESTICA SISTEMI ZA UKLANJANJE GASOVITIH POLUTANATA 10 Emisija u svetu (Mt/god) CO VOCs SOx NOx ČESTICE
FENOLI
 FENLI FENLI imaju grupu direktno vezanu na benzenov prsten i spadaju u ARMATSKE SPJEVE. Naziv fenol koristi se i za specifičan spoj, C 6 H 5 i za cijelu klasu spojeva. Sam FENL, otkriven je 1834. god.
FENLI FENLI imaju grupu direktno vezanu na benzenov prsten i spadaju u ARMATSKE SPJEVE. Naziv fenol koristi se i za specifičan spoj, C 6 H 5 i za cijelu klasu spojeva. Sam FENL, otkriven je 1834. god.
ALDEHIDI 189 O ALDEHIDI, organski spojevi koji sadržavaju grupu G H izravno vezanu za drugi atom ugljika. Zajednička im je formula dakle RC<^, gdje je
 ALDEIDI 189 O ALDEIDI, organski spojevi koji sadržavaju grupu G izravno vezanu za drugi atom ugljika. Zajednička im je formula dakle RC
ALDEIDI 189 O ALDEIDI, organski spojevi koji sadržavaju grupu G izravno vezanu za drugi atom ugljika. Zajednička im je formula dakle RC
PLINSKO
 POSTUPCI ZAVARIVANJA TALJENJEM PLINSKO ZAVARIVANJE - ALUMINOTERMIJSKO ZAVARIVANJE TALJENJEM termit lonac troska talina kalup tračnica zavareni spoj predgrijavanje ELEKTROOTPORNO ZAVARIVANJE POD TROSKOM
POSTUPCI ZAVARIVANJA TALJENJEM PLINSKO ZAVARIVANJE - ALUMINOTERMIJSKO ZAVARIVANJE TALJENJEM termit lonac troska talina kalup tračnica zavareni spoj predgrijavanje ELEKTROOTPORNO ZAVARIVANJE POD TROSKOM
L LAKOVI I BOJE (prekrivna sredstva), tvari tekuće, pastozne ili praskaste konzistencije koje, nanesene u tankom sloju na podlogu, stvaraju čvrstu pre
 L LAKOVI I BOJE (prekrivna sredstva), tvari tekuće, pastozne ili praskaste konzistencije koje, nanesene u tankom sloju na podlogu, stvaraju čvrstu prevlaku. Takva prevlaka (nalič, premaz, film) mijenja
L LAKOVI I BOJE (prekrivna sredstva), tvari tekuće, pastozne ili praskaste konzistencije koje, nanesene u tankom sloju na podlogu, stvaraju čvrstu prevlaku. Takva prevlaka (nalič, premaz, film) mijenja
Megapress sa SC-Contur Cjevovodna tehnika čelik F2 HR 4/16 Katalog 2016/2017 Prava na promjene pridržana.
 Megapress Cjevovodna tehnika čelik F2 HR 4/16 Katalog 2016/2017 Prava na promjene pridržana. Sustav press spojnica s press spojnicama od nelegiranog čelika 1.0308 za crne, poncinčane, industrijski lakirane
Megapress Cjevovodna tehnika čelik F2 HR 4/16 Katalog 2016/2017 Prava na promjene pridržana. Sustav press spojnica s press spojnicama od nelegiranog čelika 1.0308 za crne, poncinčane, industrijski lakirane
PROVEDBENA UREDBA KOMISIJE (EU) 2016/ оd 6. srpnja o odobrenju cinkova acetata dihidrata, cinkova klorida bezvodnog,
 7.7.2016. HR L 182/7 PROVEDBENA UREDBA KOMISIJE (EU) 2016/1095 оd 6. srpnja 2016. o orenju cinkova acetata dihidrata, cinkova klorida bezvodnog, cinkova oksida, cinkova sulfata heptahidrata, cinkova sulfata
7.7.2016. HR L 182/7 PROVEDBENA UREDBA KOMISIJE (EU) 2016/1095 оd 6. srpnja 2016. o orenju cinkova acetata dihidrata, cinkova klorida bezvodnog, cinkova oksida, cinkova sulfata heptahidrata, cinkova sulfata
VODA Odvodnja suvišnih voda važna je zbog načina upotrebe zemljišta. Na području Hrvatske potrebno je izgraditi, dograditi i održavati već postojeće o
 VODA Odvodnja suvišnih voda važna je zbog načina upotrebe zemljišta. Na području Hrvatske potrebno je izgraditi, dograditi i održavati već postojeće objekte za odvodnju zemljišta na površini od 1789 070
VODA Odvodnja suvišnih voda važna je zbog načina upotrebe zemljišta. Na području Hrvatske potrebno je izgraditi, dograditi i održavati već postojeće objekte za odvodnju zemljišta na površini od 1789 070
Kemija prirodnih i sintetskih polimera
 Fakultet kemijskog inženjerstva i tehnologije Sveučilište u Zagrebu Diplomski studij K E M I J S K O I N Ž E NJ E R S T V O - KTP Kolegij: Petrokemijske tehnologije Petrokemija - uvod Prof. dr. sc. Elvira
Fakultet kemijskog inženjerstva i tehnologije Sveučilište u Zagrebu Diplomski studij K E M I J S K O I N Ž E NJ E R S T V O - KTP Kolegij: Petrokemijske tehnologije Petrokemija - uvod Prof. dr. sc. Elvira
Microsoft Word - Kogen. energetski sustavi- 5. pogl..doc
 List: KOGNRACIJSKI NRGSKI SUSAVI Kogeneracija Uvjet (ograničenje) suproizvodnja električne i toplinske energije s ciljem da se smanje gubici topline koji se kod odvojene proizvodnje nepovratno gube u okolinu.
List: KOGNRACIJSKI NRGSKI SUSAVI Kogeneracija Uvjet (ograničenje) suproizvodnja električne i toplinske energije s ciljem da se smanje gubici topline koji se kod odvojene proizvodnje nepovratno gube u okolinu.
AROMATSKI KARBOHIDROGENI
 AROMATSKI KARBOHIDROGENI Benzaldehid (iz višanja, breskvi, badema) Toluen (iz Tolu balzama) Benzen, C 6 H 6, Michael Faraday, 1825. London izoliran iz uljnog ostatka gasa za osvjetljenje 1791-1867 Kekuléov
AROMATSKI KARBOHIDROGENI Benzaldehid (iz višanja, breskvi, badema) Toluen (iz Tolu balzama) Benzen, C 6 H 6, Michael Faraday, 1825. London izoliran iz uljnog ostatka gasa za osvjetljenje 1791-1867 Kekuléov
PowerPoint Presentation
 Igor Modrušan igor.modrusan@cleaneco-industrial.hr 1 2 3 4 5 6 7 8 9 10 CILJEVI PREZENTACIJE O NAMA O PROIZVODIMA KARAKTERISTIKE PROIZVODA PRIMJENA PROIZVODA LINIJA READY TO USE PROIZVODA NEKI OD NAŠIH
Igor Modrušan igor.modrusan@cleaneco-industrial.hr 1 2 3 4 5 6 7 8 9 10 CILJEVI PREZENTACIJE O NAMA O PROIZVODIMA KARAKTERISTIKE PROIZVODA PRIMJENA PROIZVODA LINIJA READY TO USE PROIZVODA NEKI OD NAŠIH
naslovnica_zup_2017
 Republika rvatska - Ministarstvo znanosti i obrazovanja Agencija za odgoj i obrazovanje - rvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 2017. PISANA ZADAĆA
Republika rvatska - Ministarstvo znanosti i obrazovanja Agencija za odgoj i obrazovanje - rvatsko kemijsko društvo ŽUPANIJSKO NATJECANJE IZ KEMIJE učenika osnovnih i srednjih škola 2017. PISANA ZADAĆA
